„Avandia“ diabeto gydymui
Prekės ženklas: AVANDIA
Bendrasis pavadinimas: rosiglitazono maleatas
Turinys:
Indikacijos ir naudojimas
Dozavimas ir administravimas
Dozavimo formos ir stiprumai
Kontraindikacijos
Įspėjimai ir atsargumo priemonės
Neigiamos reakcijos
Vaistų sąveika
Naudojimas tam tikrose populiacijose
Perdozavimas
apibūdinimas
Klinikinė farmakologija
Neklinikinė toksikologija
Klinikiniai tyrimai
Kaip tiekiama
Avandia, rosiglitazono maleatas, informacija apie pacientą (paprasta angliškai)
ĮSPĖJIMAS
KONGESINIS Širdies gedimas ir miokarda išemija
- Tiazolidindionai, įskaitant rosiglitazoną, kai kuriems pacientams sukelia ar sustiprina stazinį širdies nepakankamumą [žr. ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS]. Pradėjus AVANDIA vartojimą ir padidinus dozę, pacientą atidžiai stebėkite, ar nėra širdies nepakankamumo požymių ir simptomų (įskaitant per didelį, greitą svorio padidėjimą, dusulį ir (arba) edemą). Jei atsiranda šie požymiai ir simptomai, širdies nepakankamumas turėtų būti valdomas pagal galiojančius priežiūros standartus. Be to, reikia apsvarstyti AVANDIA vartojimo nutraukimą ar dozės mažinimą.
- AVANDIA nerekomenduojama vartoti pacientams, kuriems yra simptominis širdies nepakankamumas. AVANDIA pradėti negalima pacientams, kuriems nustatytas III ar IV klasės NYHA širdies nepakankamumas. [Pamatyti KONTRINDIKACIJOS ir ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS.]
- 42 klinikinių tyrimų metaanalizė (vidutinė trukmė 6 mėnesiai; Iš viso 14 237 pacientai), kurių dauguma AVANDIA buvo lyginami su placebu, AVANDIA buvo susijusi su padidėjusia miokardo išemijos reiškinių, tokių kaip angina ar miokardo infarktas, rizika. Kiti trys tyrimai (vidutinė trukmė 41 mėn.; Iš viso 14 067 pacientai), palyginus AVANDIA su kai kuriais kitais patvirtintais geriamaisiais vaistais nuo diabeto ar placebu, šios rizikos nei patvirtino, nei atmetė. Visi turimi duomenys apie miokardo išemijos riziką yra neabejotini. [Pamatyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS.]
viršuje
Indikacijos ir naudojimas
Monoterapija ir kombinuota terapija
AVANDIA skiriamas kaip priedas prie dietos ir mankštos, siekiant pagerinti glikemijos kontrolę suaugusiesiems, sergantiems 2 tipo cukriniu diabetu.
Svarbūs naudojimo apribojimai
- Dėl veikimo mechanizmo AVANDIA veikia tik esant endogeniniam insulinui. Todėl AVANDIA neturėtų būti skiriamas pacientams, sergantiems 1 tipo cukriniu diabetu ar diabetinei ketoacidozei gydyti.
- Nerekomenduojama kartu vartoti AVANDIA ir insulino.
- AVANDIA vartoti kartu su nitratais nerekomenduojama.
viršuje
Dozavimas ir administravimas
Antidiabetinis gydymas turėtų būti individualizuotas. Visi pacientai turėtų pradėti vartoti AVANDIA mažiausiomis rekomenduojamomis dozėmis. Toliau didinant AVANDIA dozę, reikia atidžiai stebėti, ar nėra nepageidaujamų reiškinių, susijusių su skysčių susilaikymu [žr Įspėjimas dėžutėje ir ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS].
AVANDIA gali būti skiriama pradine 4 mg doze, vartojama kaip viena paros dozė arba padalijama į dvi dalis. Pacientams, kurių atsakas nepakankamas po 8–12 gydymo savaičių, nustatomas sumažėjus gliukozės koncentracijai nevalgius plazmoje (FPG), dozę galima padidinti iki 8 mg per parą monoterapijos būdu arba kartu su metforminu, sulfonilkarbamidu ar sulfonilkarbamidu plius metformino. Glikemijos parametrų sumažėjimas atsižvelgiant į dozę ir režimą aprašytas klinikiniuose tyrimuose. AVANDIA galima vartoti valgant ar nevalgius.
Bendra AVANDIA paros dozė neturi viršyti 8 mg.
Monoterapija
Įprasta pradinė AVANDIA dozė yra 4 mg, skiriama kaip viena dozė kartą per parą arba dalijama dozėmis du kartus per dieną. Klinikinių tyrimų metu 4 mg du kartus per parą vartojimo schema labiausiai sumažino FPG ir hemoglobino A1c (HbA1c) kiekį.
Derinys su sulfonilkarbamidu ar metforminu
Pridėjus AVANDIA prie esamos terapijos, pradėjus gydymą AVANDIA, galima toliau vartoti esamą (-as) vaisto (-ų) dozę (-es).
Sulfonilkarbamidas: Kai vartojama kartu su sulfonilkarbamidu, įprasta pradinė AVANDIA dozė yra 4 mg, vartojama kaip viena dozė vieną kartą per parą arba dalijant du kartus per parą. Jei pacientai praneša apie hipoglikemiją, sulfonilkarbamido dozę reikia sumažinti.
Metforminas: Įprasta pradinė AVANDIA dozė kartu su metforminu yra 4 mg, vartojama kaip viena dozė vieną kartą per parą arba dalijama dozėmis du kartus per parą. Dėl hipoglikemijos derinant gydymą AVANDIA vargu ar reikės koreguoti metformino dozę.
Derinys su sulfonilurėjos dariniu plius metforminu
Įprasta pradinė AVANDIA dozė kartu su sulfonilurėjos dariniu kartu su metforminu yra 4 mg, vartojama kaip viena dozė vieną kartą per parą arba dalijama dozė du kartus per parą. Jei pacientai praneša apie hipoglikemiją, sulfonilkarbamido dozę reikia sumažinti.
Specifinės pacientų populiacijos
Inkstų funkcijos sutrikimas: Dozavimo koreguoti nereikia, kai AVANDIA skiriama monoterapijai pacientams, kurių inkstų funkcija sutrikusi. Kadangi metforminas tokiems pacientams draudžiamas, metformino kartu su AVANDIA vartoti draudžiama ir pacientams, kurių inkstų funkcija sutrikusi.
Kepenų funkcijos sutrikimas: Prieš pradedant gydymą AVANDIA, reikia išmatuoti kepenų fermentų kiekį. Gydymo AVANDIA negalima pradėti, jei pacientas turi klinikinių aktyvaus poveikio įrodymų kepenų liga arba padidėjęs transaminazių kiekis serume (ALT> 2,5 karto viršutinė normos riba 2007 m. pradžioje) terapija). Pradėjus AVANDIA, kepenų fermentus reikia periodiškai tikrinti, atsižvelgiant į sveikatos priežiūros specialisto klinikinius sprendimus. [Pamatyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS ir KLINIKINĖ FARMAKOLOGIJA.]
Pediatrija: Duomenų nepakanka, kad būtų galima rekomenduoti AVANDIA vartojimą vaikams [žr NAUDOJIMAS KONKRETUOSE GYVENIMUOSE].
viršuje
Dozavimo formos ir stipriosios pusės
Penkiakampėje plėvele dengtoje TILTAB tabletėje yra maleato pavidalo rosiglitazono:
- 2 mg - rožinės spalvos, su įspaudu SB vienoje pusėje ir 2 kitoje
- 4 mg - oranžinės spalvos, vienoje pusėje įspaustas SB, kitoje - 4
- 8 mg - raudonai rudos spalvos, su įspaudu SB vienoje pusėje ir 8 kitoje
viršuje
Kontraindikacijos
AVANDIA pradėti gydyti pacientams, kuriems nustatyta Niujorko širdies asociacijos (NYHA) III ar IV klasės širdies nepakankamumas. DĖŽUTĖS ĮSPĖJIMAS].
viršuje
Įspėjimai ir atsargumo priemonės
Širdies nepakankamumas
AVANDIA, kaip ir kiti tiazolidindionai, atskirai arba kartu su kitais antidiabetiniais vaistais, gali sukelti skysčių susilaikymą, kuris gali sustiprėti arba sukelti širdies nepakankamumą. Pacientus reikia stebėti dėl širdies nepakankamumo požymių ir simptomų. Jei atsiranda šie požymiai ir simptomai, širdies nepakankamumas turėtų būti valdomas pagal galiojančius priežiūros standartus. Be to, reikia apsvarstyti galimybę nutraukti arba sumažinti roziglitazono dozę [žr DĖŽUTĖS ĮSPĖJIMAS].
Pacientams, sergantiems staziniu širdies nepakankamumu (CHF), I ir II klasės NYHA, gydomi AVANDIA, padidėja širdies ir kraujagyslių ligų rizika. 52 savaičių dvigubai aklas, placebu kontroliuojamas echokardiografinis tyrimas buvo atliktas 224 2 tipo pacientams. cukrinis diabetas ir NYHA I arba II klasės CHF (išstūmimo frakcija - 45%) fone antidiabetinis ir CHF terapija. Nepriklausomas komitetas aklai vertino su skysčiais susijusius įvykius (įskaitant stazinis širdies nepakankamumas) ir hospitalizacijos širdies ir kraujagyslių sistemoje pagal iš anksto nustatytus kriterijus (teismo sprendimas). Tyrėjai pranešė atskirai nuo teismo sprendimo apie kitus nepageidaujamus širdies ir kraujagyslių reiškinius. Nors gydymo skirtumų, lyginant su išstūmimo frakcijų pokyčiais, skirtumo nepastebėta, daugiau gydymo AVANDIA metu, palyginti su placebu, stebėtas nepageidaujamas širdies ir kraujagyslių reiškinys 52 savaičių tyrimas. (Žr. 1 lentelę)
1 lentelė. Atsiradę širdies ir kraujagyslių sistemos nepageidaujami reiškiniai pacientams, sergantiems staziniu širdies nepakankamumu (I ir II NYHA klasės), gydomi AVANDIA arba placebu (papildomai skiriant priešdiabetinį ir švirkščiamąjį gydymą).
| Renginiai | AVANDIJA N = 110 n (%) |
Placebas N = 114 n (%) |
| Priimtas sprendimas | ||
| Širdies ir kraujagyslių sistemos mirtys | 5 (5%) | 4 (4%) |
| CHF pablogėjimas | 7 (6%) | 4 (4%) |
| - su nakvyne ligoninėje | 5 (5%) | 4 (4%) |
| - be hospitalizacijos per naktį | 2 (2%) | 0 (0%) |
| Nauja ar pasunkėjusi edema | 28 (25%) | 10 (9%) |
| Naujas ar pablogėjęs dusulys | 29 (26%) | 19 (17%) |
| Padidėjęs CHF gydymas vaistais | 36 (33%) | 20 (18%) |
| Širdies ir kraujagyslių ligų hospitalizavimas * | 21 (19%) | 15 (13%) |
| Tyrėjo pranešta, neskundžiama | ||
| Išeminiai nepageidaujami reiškiniai | 10 (9%) | 5 (4%) |
| - Miokardinis infarktas | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Įtraukiama hospitalizacija dėl bet kokių širdies ir kraujagyslių ligų priežasčių. |
AVANDIA pradėti negalima pacientams, kuriems nustatytas III ar IV klasės NYHA širdies nepakankamumas. AVANDIA nerekomenduojama vartoti pacientams, kuriems yra simptominis širdies nepakankamumas. [Pamatyti DĖŽUTĖS ĮSPĖJIMAS.]
Kontroliuojamų klinikinių tyrimų metu pacientai, kuriems pasireiškė ūmus koronarinis sindromas, nebuvo tirti. Atsižvelgiant į galimą širdies nepakankamumo išsivystymą pacientams, sergantiems ūminiu vainikinių kraujagyslių reiškiniu, AVANDIA pradėti nereikia rekomenduojama pacientams, kuriems pasireiškia ūmus koronarinis reiškinys, ir AVUDIA vartojimą reikia nutraukti šios ūminės fazės metu laikomas.
Kontroliuojamų klinikinių tyrimų metu pacientai, sergantys III ir IV klasės NYHA širdies būkle (su CHF ar be jo), nebuvo tirti. AVANDIA nerekomenduojama vartoti pacientams, kuriems yra III ir IV klasės NYHA širdies būklė.
Miokardo išemija
Miokardo išemijos metaanalizė 42 klinikinių tyrimų grupėje
Metaanalizė buvo atlikta retrospektyviai, siekiant įvertinti nepageidaujamus širdies ir kraujagyslių reiškinius, pastebėtus per 42 dvigubai aklus, atsitiktinių imčių, kontroliuojamus klinikinius tyrimus (vidutinė trukmė 6 mėnesiai).1
Šie tyrimai buvo atlikti siekiant įvertinti gliukozės kiekį mažinantį veiksmingumą sergant 2 tipo cukriniu diabetu, o perspektyviai planuojamo širdies ir kraujagyslių reiškinių sprendimo nebuvo. Kai kurie tyrimai buvo kontroliuojami placebu, o kai kurie buvo naudojami kaip aktyvūs geriamieji vaistai nuo diabeto. Placebu kontroliuojami tyrimai apėmė monoterapijos tyrimus (monoterapija AVANDIA, palyginti su placebo monoterapija) ir papildomus tyrimus (AVANDIA arba placebas, pridedant prie sulfonilkarbamido, metformino ar insulino). Aktyvieji kontroliniai tyrimai apėmė monoterapijos tyrimus (monoterapiją AVANDIA, palyginti su sulfonilkarbamidu ar metforminu) monoterapija) ir papildomi tyrimai (AVANDIA ir sulfonilkarbamido arba AVANDIA plius metforminas, palyginti su sulfonilkarbamido pliusas) metforminas). Iš viso įtraukti 14 237 pacientai (8 604 gydymo grupėse, kuriose yra AVANDIA, 5 633 pacientai) lyginamosios grupės), kai AVANDIA ekspozicija buvo 4143 paciento metai ir 2 675 paciento metai lyginamasis. Išeminiai miokardo reiškiniai: krūtinės angina, paūmėjusi krūtinės angina, nestabili krūtinės angina, širdies sustojimas, krūtinės skausmas, koronarinė arterijų okliuzija, dusulys, miokardo infarktas, vainikinių kraujagyslių trombozė, miokardo išemija, vainikinių arterijų liga ir vainikinė arterija sutrikimas. Atliekant šią analizę padidėjo miokardo išemijos rizika vartojant AVANDIA, palyginti su junginiais buvo stebimas (2% AVANDIA palyginti su 1,5% palyginamųjų, šansų santykis 1,4, 95% pasikliautinasis intervalas [CI] 1,1, 1.8). Padidėjusi miokardo išemijos rizika vartojant AVANDIA buvo pastebėta placebo kontroliuojamais tyrimais, bet ne aktyviais kontroliuojamais tyrimais. (Žr. 1 pav.)
Didesnė miokardo išemijos rizika buvo pastebėta tyrimuose, kuriuose buvo pridėta AVANDIA insulinui (2,8% AVANDIA plius insulinui palyginti su 1,4% placebu plius insulinui [OR 2,1, 95% PI 0,9, 5.1]). Padidėjusi rizika atspindi 3 reiškinių per 100 paciento metų skirtumą (95% PI –0,1, 6,3) gydymo grupėse. [Pamatyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS.]
Figūra 1. Miškinis miokardo išeminių įvykių koeficientų santykis (95% patikimumo intervalai) metaanalizėje 42 klinikiniuose tyrimuose

Didesnė miokardo išemijos rizika taip pat pastebėta pacientams, kurie buvo gydomi AVANDIA ir fono nitratais. AVANDIA (N = 361) ir kontrolinės (N = 244) nitratų vartotojams šansų santykis buvo 2,9 (95% PI 1,4, 5.9), tuo tarpu ne nitratų vartotojams (iš viso apie 14 000 pacientų) šansų santykis buvo 1,3 (95% PI 0,9, 1.7). Padidėjusi rizika rodo 12 miokardo išemijos įvykių skirtumą per 100 paciento metų (95% PI 3,3, 21,4). Daugeliui nitratų vartotojų buvo nustatyta koronarinė širdies liga. Pacientams, kuriems diagnozuota koronarinė širdies liga ir kurie nebuvo gydomi nitratais, AVANDIA, palyginti su palyginamuoju preparatu, padidėjusi miokardo išemijos rizika nebuvo įrodyta.
Miokardo išemijos atvejai atliekant didelius ilgalaikius atsitiktinių imčių kontroliuojamus AVANDIA tyrimus
3 kitų didelių, ilgalaikių, perspektyvių, atsitiktinių imčių, kontroliuojamų AVANDIA klinikinių tyrimų duomenys buvo vertinami atskirai nuo metaanalizės. Šiuose 3 tyrimuose iš viso dalyvavo 14 067 pacientai (gydymo grupių, kurių sudėtyje yra AVANDIA N = 6 311, palyginamasis) grupės N = 7 756), kai paciento metų ekspozicija yra 21 803 paciento metai AVANDIA ir 25 998 paciento metai pacientams lyginamasis. Kiekviename tyrime stebėjimo trukmė viršijo 3 metus. ADOPT (tyrimas dėl diabeto rezultatų progresavimo) buvo 4–6 metų atsitiktinių imčių aktyvus kontroliuojamas tyrimas, kuriame dalyvavo neseniai diagnozuoti pacientai, sergantys 2 tipo cukriniu diabetu.
Tai buvo veiksmingumo ir bendrosios saugos tyrimas, kurio tikslas buvo ištirti
AVANDIA kaip monoterapija (N = 1,456), skirta glikemijos kontrolei sergant 2 tipo cukriniu diabetu, su sulfonilkarbamido monoterapijos palyginamosiomis grupėmis (N = 1 441) ir metformino monoterapija (N = 1 454). DREAM (diabeto sumažėjimo įvertinimas naudojant Rosiglitazon ir Ramipril vaistus; paskelbta ataskaita2) buvo 3–3 5 metų atsitiktinių imčių, placebu kontroliuojamas tyrimas pacientams, kurių sutrikusi gliukozės tolerancija ir (arba) nevalgius gliukoze. Jis turėjo 2 x 2 faktorinį planą, skirtą įvertinti AVANDIA ir atskirai ramiprilio (angiotenziną konvertuojančio fermento inhibitoriaus [ACEI]) poveikį progresuojant akivaizdžiam diabetui. DREAM metu 2635 pacientai buvo gydymo grupėse, kuriose yra AVANDIA, ir 2634 pacientai buvo gydymo grupėse, kurių sudėtyje nėra AVANDIA AVANDIA.Skelbti tarpiniai rezultatai, gauti RECORD (Rosiglitazonas įvertintas dėl širdies veiklos rezultatų ir glikemijos reguliavimo) metu. Diabetas), vykstantis atviras 6 metų širdies ir kraujagyslių ligų tyrimas pacientams, sergantiems 2 tipo cukriniu diabetu, kurių vidutinis gydymas trukmė 3,75 metai. Į RECORD įtraukiami pacientai, kuriems metformino ar sulfonilkarbamido monoterapija buvo nesėkminga; tie, kuriems metforminas nepavyko, atsitiktiniu būdu pasirenka papildomą AVANDIA arba papildomą sulfonilkarbamidą, ir tie, kuriems nepavyko sulfonilkarbamido, yra atsitiktiniu būdu gaunami arba su papildomu AVANDIA, arba su priedu metformino. Pagal RECORD programą iš viso 2220 pacientų gydosi papildoma AVANDIA, o 2227 pacientai naudojasi vienu iš papildomo gydymo režimų, kuriuose nėra AVANDIA.
Šių 3 tyrimų metu analizė buvo atlikta naudojant pagrindinių nepageidaujamų širdies ir kraujagyslių reiškinių (miokardo infarkto, mirties nuo širdies ar kraujagyslių sistemos ar insulto), toliau vadinamų MACE, rinkinį. Ši baigtis skyrėsi nuo metaanalizės plataus miokardo išemijos įvykių, kurių daugiau nei pusė buvo angina, baigties. Miokardo infarktas apėmė mirtiną ir nemirtiną miokardo infarktą bei staigią mirtį. Kaip parodyta 2 paveiksle, 3 rodiklių (MACE, MI ir viso mirštamumo) rezultatai statistiškai reikšmingai nesiskyrė tarp AVANDIA ir palyginamųjų.
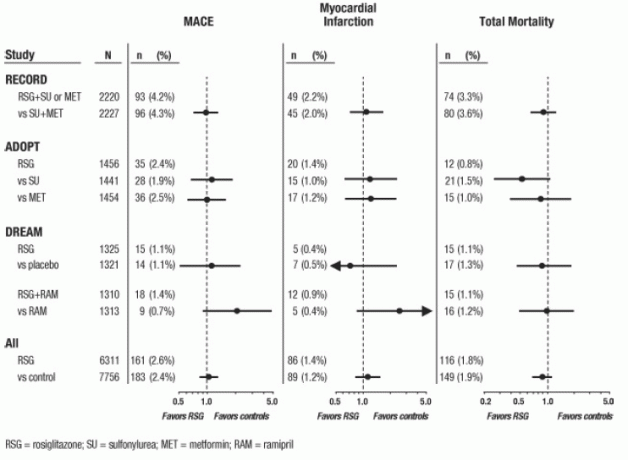
Preliminarioje DREAM tyrimo analizėje širdies ir kraujagyslių reiškinių dažnis buvo didesnis tarp tiriamųjų vartojo AVANDIA kartu su ramipriliu nei tiriamieji, kurie vartojo tik ramiprilį, kaip parodyta 4.2 skyriuje 2 pav. Ši išvada nepatvirtinta ADOPT ir RECORD (aktyvaus kontroliuojamo diabeto pacientų tyrimuose), kuriuose atitinkamai 30% ir 40% pacientų pranešė apie pradinį ACE inhibitorių vartojimą.
Visi turimi duomenys apie miokardo išemijos riziką yra neabejotini. Galutinių išvadų dėl šios rizikos laukiama, kai bus baigtas tinkamai parengtas širdies ir kraujagyslių sistemos tyrimų tyrimas.
Nebuvo atlikta klinikinių tyrimų, patvirtinančių įtikinamų makrovaskulinės rizikos sumažėjimo atvejų, vartojant AVANDIA ar bet kurį kitą geriamąjį diabeto vaistą.
Stazinis širdies nepakankamumas ir miokardo išemija, vartojant AVANDIA kartu su insulinu
Tyrimuose, kuriuose AVANDIA buvo pridėta prie insulino, AVANDIA padidino stazinio širdies nepakankamumo ir miokardo išemijos riziką. (Žr. 2 lentelę)
Nerekomenduojama kartu vartoti AVANDIA ir insulino. [Pamatyti Indikacijos ir naudojimas ir ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS.]
Per penkis, 26 savaičių, kontroliuojamus, atsitiktinių imčių, dvigubai aklus tyrimus, kurie buvo įtraukti į metaanalizę [žr ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS] pacientai, sergantys 2 tipo cukriniu diabetu, buvo atsitiktinai suskirstyti į AVANDIA ir insulino (N = 867) arba insulino (N = 663) vartojimą. Šių 5 tyrimų metu AVANDIA buvo pridėta prie insulino. Šiuose tyrimuose dalyvavo pacientai, sergantys ilgalaikiu cukriniu diabetu (vidutinė trukmė 12 metų) ir dideliu jų paplitimu medicininės būklės, įskaitant periferinę neuropatiją, retinopatiją, išeminę širdies ligą, kraujagyslių ligas ir stazinę širdį nesėkmė. AVANDIA ir insulino grupėse atitinkamai buvo 21 (2,4%) ir 7 (1,1%) pacientai, kuriems pasireiškė stazinis širdies nepakankamumas. AVANDIA ir insulino grupėse atitinkamai 24 (2,8%) ir 9 (1,4%) pacientai, kuriems pasireiškė miokardo išemija (OR 2,1 (95% CI 0,9, 5,1)). Nors tirtų stazinio širdies nepakankamumo ir miokardo išemijos atvejų dažnis buvo mažas gyventojų, nuosekliai įvykių dažnis buvo 2 kartus didesnis ar didesnis kartu skiriant AVANDIA ir insulino. Šie širdies ir kraujagyslių reiškiniai buvo pastebėti vartojant tiek 4 mg, tiek 8 mg AVANDIA paros dozes. (Žr. 2 lentelę)
2 lentelė. Širdies ir kraujagyslių reiškinių pasikartojimas 5 kontroliuojamuose AVANDIA papildymo gydymu insulinu tyrimuose
| Renginys * | AVANDIA + insulinas (n = 867) n (%) |
Insulinas (n = 663) n (%) |
| Stazinis širdies nepakankamumas | 21 (2.4%) | 7 (1.1%) |
| Miokardo išemija | 24 (2.8%) | 9 (1.4%) |
| Širdies ir kraujagyslių sistemos mirties, miokardo infarkto ar insulto sudėtis | 10 (1.2%) | 5 (0.8%) |
| Insultas | 5 (0.6%) | 4 (0.6%) |
| Miokardinis infarktas | 4 (0.5%) | 1 (0.2%) |
| Širdies ir kraujagyslių sistemos mirtis | 4 (0.5%) | 1 (0.2%) |
| Visos mirtys | 6 (0.7%) | 1 (0.2%) |
| * Renginiai nėra išskirtiniai; y., pacientas, kurio širdies ir kraujagyslių liga mirė dėl miokardo infarkto, būtų priskiriamas 4 įvykių kategorijoms (miokardo išemija; širdies ir kraujagyslių sistemos mirtis, miokardo infarktas ar insultas; miokardinis infarktas; širdies ir kraujagyslių sistemos mirtis). |
Šeštame, 24 savaičių, kontroliuojamame, atsitiktinių imčių, dvigubai koduotame AVANDIA ir insulino vartojimo kartu tyrime, į AVANDAMET® buvo pridėta insulino. (rosiglitazono maleato ir metformino HCl) (n = 161) ir, palyginti su insulinu ir placebu (n = 158), po vienkartinio aklino 8 savaičių prisijungimo su AVANDAMETAS. Pacientai, sergantys edema, kuriems reikalingas farmakologinis gydymas, ir pacientai, sergantys staziniu širdies nepakankamumu, nebuvo įtraukti į pradinę būklę ir gydymo laikotarpiu.
AVANDAMET ir insulino vartojusių pacientų grupėje buvo vienas miokardo išemijos atvejis ir viena staigi mirtis. Insulino grupėje miokardo išemijos nepastebėta, o stazinio širdies nepakankamumo nepranešta nė vienoje gydymo grupėje.
Edema
AVANDIA reikia atsargiai skirti pacientams, sergantiems edema. Klinikiniame tyrime su sveikais savanoriais, kurie 8 savaites vartojo 8 mg AVANDIA kartą per parą, statistiškai reikšmingai padidėjo vidutinė plazmos tūris, palyginti su placebu.
Kadangi tiazolidindionai, įskaitant rosiglitazoną, gali sukelti skysčių susilaikymą, o tai gali dėl stazinio širdies nepakankamumo, AVANDIA reikia atsargiai skirti pacientams, kuriems yra širdies rizika nesėkmė. Pacientus reikia stebėti, ar nėra širdies nepakankamumo požymių ir simptomų [žr DĖŽUTĖS ĮSPĖJIMAS, ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS ].
Kontroliuojamų klinikinių pacientų, sergančių 2 tipo diabetu, tyrimų metu AVANDIA gydomiems pacientams pasireiškė lengva ar vidutinio sunkumo edema, kuri gali priklausyti nuo dozės. Pradėjusiems kombinuotą gydymą insulinu ir AVANDIA, pacientams, sergantiems edema, labiau tikėtini nepageidaujami reiškiniai, susiję su edema [žr. NEPALANKIOS REAKCIJOS].
Svorio priaugimas
Su doze susijęs svorio padidėjimas pastebėtas vartojant vien AVANDIA ir kartu su kitais hipoglikemija (3 lentelė). Svorio padidėjimo mechanizmas nėra aiškus, tačiau greičiausiai tai susiję su skysčių susilaikymu ir riebalų kaupimu.
Po pateikimo į rinką patirties buvo gauta pranešimų apie neįprastai greitą svorio augimą ir daugiau nei paprastai klinikinių tyrimų metu. Pacientai, kuriems pasireiškia toks padidėjimas, turi būti įvertinti dėl skysčių kaupimosi ir tūrio pokyčių, tokių kaip per didelė edema ir stazinis širdies nepakankamumas [žr. DĖŽUTĖS ĮSPĖJIMAS].
3 lentelė. Svorio pokyčiai (kg), palyginti su pradiniu rodikliu, klinikinių tyrimų metu
| Monoterapija | Trukmė | Kontrolinė grupė | AVANDIJA 4 mg Vidutinė (25, 75 procentilė) |
AVANDIJA 8 mg Vidutinė (25, 75 procentilė) |
|
| Vidutinė (25, 75 procentilė) | |||||
| 26 savaitės | placebas | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 savaitės | sulfonilkarbamidas | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Kombinuota terapija | |||||
| Sulfonilkarbamidas | 24–26 savaitės | sulfonilkarbamidas | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metforminas | 26 savaitės | metformino | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulinas | 26 savaitės | insulino | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonilkarbamidas + metforminas | 26 savaitės | sulfonilkarbamidas + metforminas | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
Per 4-6 metų monoterapinį palyginamąjį tyrimą (ADOPT) pacientams, kuriems neseniai diagnozuotas 2 tipo cukrinis diabetas, anksčiau nebuvo gydyti antidiabetiniais vaistais [žr. Klinikinė studijas], vidutinis svorio pokytis (25%)tūkst, 75tūkst procentiliai) nuo pradinio 4 metų amžiaus buvo 3,5 kg (0,0, 8,1) AVANDIA, 2,0 kg (-1,0, 4,8) glicuridui ir -2,4 kg (-5,4, 0,5) metforminui.
24 savaičių tyrime, kuriame dalyvavo vaikai nuo 10 iki 17 metų, gydomi AVANDIA 4–8 mg per parą, vidutinis kūno svorio padidėjimas buvo 2,8 kg (25).tūkst, 75tūkst procentiliai: 0,0, 5,8).
Poveikis kepenims
Prieš pradedant gydymą AVANDIA, kepenų fermentus reikia matuoti visiems pacientams ir periodiškai po to, atsižvelgiant į sveikatos priežiūros specialisto klinikinius sprendimus. Gydymo AVANDIA negalima pradėti pacientams, kurių pradinis kepenų fermentų kiekis yra padidėjęs (ALT> 2,5 karto viršija normos ribą). Pacientai, kurių pradinis kepenų fermentų kiekis padidėjo šiek tiek (ALT lygis ≥ 2,5x viršutinė normos riba) prieš pradedant gydymą. arba gydymo AVANDIA metu turi būti įvertinta kepenų fermento priežastis pakilimas. Pradėti arba tęsti gydymą AVANDIA pacientams, kuriems padidėjęs kepenų fermentų kiekis, reikia atsargiai ir apima kruopštų klinikinį stebėjimą, įskaitant kepenų fermentų stebėjimą, siekiant nustatyti, ar kepenų fermentų padidėjimas išnyksta, ar pablogėti. Jei pacientams, gydomiems AVANDIA, bet kuriuo metu ALAT lygis padidėja iki> 3X viršutinės normos viršutinės ribos, kepenų fermentų kiekį reikia patikrinti kuo greičiau. Jei ALT koncentracija išlieka> 3X viršutinė normos riba, gydymą AVANDIA reikia nutraukti.
Jei pacientui pasireiškia simptomai, rodantys kepenų funkcijos sutrikimą, tai gali būti nepaaiškinamas pykinimas, vėmimas, pilvo skausmas, nuovargis, anoreksija ir (arba) tamsus šlapimas, reikia patikrinti kepenų fermentus. Priimant sprendimą tęsti paciento gydymą AVANDIA, turėtų būti vadovaujamasi klinikiniais sprendimais, kol bus atlikti laboratoriniai tyrimai. Pastebėjus gelta, vaistų vartojimą reikia nutraukti. [Pamatyti NEPALANKIOS REAKCIJOS.]
Makulinė edema
Kai kurių cukriniu diabetu sergančių pacientų, vartojusių AVANDIA ar kitą tiazolidindioną, metu buvo gauta geltonosios dėmės edema. Kai kuriems pacientams nustatytas neryškus matymas ar sumažėjęs regėjimo aštrumas, tačiau kai kuriems pacientams diagnozuotas įprastas oftalmologinis tyrimas. Tuo metu, kai buvo diagnozuota geltonosios dėmės edema, daugumai pacientų pasireiškė periferinė edema. Kai kuriems pacientams pagerėjo geltonosios dėmės edema nutraukus tiazolidindiono vartojimą. Pagal Amerikos diabeto asociacijos priežiūros standartus pacientams, sergantiems cukriniu diabetu, turėtų būti reguliariai atliekamas akių gydytojo tyrimas. Be to, bet kuris diabetas, pranešęs apie bet kokius regėjimo simptomus, turėtų būti nedelsiant nukreiptas į oftalmologą, neatsižvelgiant į paciento vartojamus vaistus ar kitus fizinius duomenis. [Pamatyti NEPALANKIOS REAKCIJOS.]
Lūžiai
Neseniai 4–6 metų lyginamasis tyrimas (ADOPT) su gliukozės koncentracijos kontrole kartu su monoterapija pacientams, kurie anksčiau nebuvo vartoję vaistų diagnozuotas 2 tipo cukrinis diabetas, vartojusių moterų padidėjo kaulų lūžių dažnis AVANDIJA. Moterų kaulų lūžių dažnis per 4–6 metus buvo 9,3% (60/645), vartojant AVANDIA, palyginti su 3,5% (21/605) glicuridu ir 5,1% (30/590) metforminu. Šis padidėjęs dažnis buvo pastebėtas po pirmųjų gydymo metų ir išliko viso tyrimo metu. Dauguma AVANDIA vartojusių moterų lūžių buvo žasto, rankos ir pėdos. Šios lūžio vietos skiriasi nuo vietų, paprastai susijusių su osteoporoze po menopauzės (pvz., Klubo ar stuburo). AVANDIA gydytiems vyrams lūžių dažnio padidėjimas nepastebėtas. Reikėtų atsižvelgti į lūžių riziką, kai pacientai, ypač moterys, gydomi AVANDIA ir dėmesys, skiriamas kaulų sveikatos vertinimui ir palaikymui pagal dabartinius rūpintis.
Hematologinis poveikis
Vidutinis hemoglobino ir hematokrito sumažėjimas pasireiškė atsižvelgiant į dozę suaugusiems pacientams, gydytiems AVANDIA [žr. NEPALANKIOS REAKCIJOS]. Stebimi pokyčiai gali būti susiję su padidėjusiu plazmos tūriu, stebėtu gydant AVANDIA.
Diabetas ir gliukozės kiekio kraujyje kontrolė
Pacientams, vartojantiems AVANDIA kartu su kitais hipoglikemija, gali kilti hipoglikemijos rizika, todėl gali reikėti sumažinti kartu vartojamų vaistų dozę.
Norint stebėti terapinį atsaką, reikia periodiškai matuoti nevalgius gliukozės ir HbA1c kraujyje.
Ovuliacija
Gydymas AVANDIA, kaip ir kiti tiazolidindionai, gali sukelti ovuliaciją kai kurioms prieš menopauzę anovuliacinėms moterims. Todėl vartojant AVANDIA šiems pacientams gali padidėti nėštumo rizika [žr Naudojimas tam tikrose populiacijose]. Taigi moterims prieš menopauzę turėtų būti rekomenduojama tinkama kontracepcija. Šis galimas poveikis nebuvo konkrečiai ištirtas klinikinių tyrimų metu; todėl šio įvykio dažnis nežinomas.
Nors ikiklinikinių tyrimų metu buvo pastebėtas hormonų pusiausvyros sutrikimas [žr Neklinikinė toksikologija], šio atradimo klinikinė reikšmė nežinoma. Jei atsiranda netikėta menstruacijų disfunkcija, reikia persvarstyti tolesnio gydymo AVANDIA naudą.
viršuje
Neigiamos reakcijos
Klinikinio tyrimo patirtis
Suaugęs
Klinikinių tyrimų metu AVANDIA buvo gydoma maždaug 9 900 pacientų, sergančių 2 tipo diabetu.
Trumpalaikiai AVANDIA, kaip monoterapijos ir derinio su kitais hipoglikemijos agentais, tyrimai
Nepageidaujamų reiškinių dažnis ir tipai, apie kuriuos pranešta atliekant trumpalaikius AVANDIA monoterapijos klinikinius tyrimus, parodyti 4 lentelėje.
4 lentelė. Nepageidaujami reiškiniai (~ 5% bet kurioje gydymo grupėje), apie kuriuos pranešė pacientai, kuriems trumpalaikiai * dvigubai akli klinikiniai tyrimai, skirti AVANDIA kaip monoterapiją
| Pageidaujamas terminas | AVANDIJA Monoterapija N = 2,526 % |
Placebas N = 601 % |
Metforminas N = 225 % |
Sulfonilkarbamidas N = 626 % |
| Viršutinių kvėpavimo takų infekcija | 9.9 | 8.7 | 8.9 | 7.3 |
| Sužalojimas | 7.6 | 4.3 | 7.6 | 6.1 |
| Galvos skausmas | 5.9 | 5.0 | 8.9 | 5.4 |
| Nugaros skausmas | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglikemija | 3.9 | 5.7 | 4.4 | 8.1 |
| Nuovargis | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinusitas | 3.2 | 4.5 | 5.3 | 3.0 |
| Viduriavimas | 2.3 | 3.3 | 15.6 | 3.0 |
| Hipoglikemija | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Trumpalaikiai tyrimai truko nuo 8 savaičių iki 1 metų. †Įskaitant pacientus, vartojančius gliburidą (N = 514), gliklazidą (N = 91) arba glipizidą (N = 21). |
Apskritai, nepageidaujamų reakcijų tipai, neatsižvelgiant į priežastinį ryšį, apie kuriuos pranešta vartojant AVANDIA kartu su sulfonilkarbamidu ar metforminu buvo panašūs į tuos, kurie buvo gydomi monoterapija AVANDIJA.
Anemijos ir edemos atvejai buvo linkę pranešti dažniau vartojant didesnes dozes ir paprastai buvo lengvi ar vidutinio sunkumo ir dėl jų gydymo AVANDIA nutraukti paprastai nereikėjo.
Dvigubai akluose tyrimuose anemija pasireiškė 1,9% pacientų, gydytų AVANDIA monoterapija, palyginti su 0,7% placebo, 0,6% sulfonilkarbamido ir 2,2% vartojusių metformino. Anemijos atvejų buvo daugiau pacientams, gydytiems AVANDIA ir metformino deriniu (7,1%) ir AVANDIA ir sulfonilšlapalo dariniai kartu su metforminu (6,7%), palyginti su monoterapija AVANDIA arba kartu su sulfonilšlapalo dariniu (2.3%). Mažesnis ikimokyklinio gydymo hemoglobino / hematokrito kiekis pacientams, dalyvavusiems metformino derinio klinikiniuose tyrimuose, galėjo prisidėti prie didesnio anemijos atvejų pranešimo šiuose tyrimuose [žr. NEPALANKIOS REAKCIJOS].
Klinikinių tyrimų metu edema pasireiškė 4,8% pacientų, gydytų AVANDIA monoterapija, palyginti su 1,3% vartojusių placebą, 1,0% vartojusių sulfonilkarbamidą ir 2,2% vartojusių metformino. Pranešta, kad edemos dažnis buvo didesnis vartojant AVANDIA 8 mg sulfonilkarbamido deriniuose (12,4%), palyginti su kitais deriniais, išskyrus insuliną. Edema pasireiškė 14,7% pacientų, gydytų AVANDIA insulino derinio tyrimais, palyginti su 5,4% vien tik insulino. Pranešimų apie stazinio širdies nepakankamumo atsiradimą ar paūmėjimą pasireiškė vartojant 1% insulino, 2% (4 mg) ir 3% (8 mg) kartu su AVANDIA [žr. DĖŽUTĖS ĮSPĖJIMAS ir ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS].
Kontroliuojamų kombinuotų gydymo sulfonilkarbamidų tyrimais metu buvo pranešta apie lengvus ar vidutinio sunkumo hipoglikemijos simptomus, kurie atrodo priklausomi nuo dozės. Nedaugeliui pacientų buvo pašalinta hipoglikemija (<1%), o keli hipoglikemijos epizodai buvo laikomi sunkiais (<1%). Hipoglikemija buvo dažniausias nepageidaujamas reiškinys fiksuotų dozių insulino derinio tyrimuose, nors nedaugelis pacientų pasitraukė dėl hipoglikemijos (4 iš 408 vartojusiems AVANDIA ir insulino, 1 iš 203 - dėl insulino) atskirai). Hipoglikemijos dažnis, kurį patvirtina kapiliarinė gliukozės koncentracija kraujyje 50 mg / dL, buvo 6% vien tik insulino ir 12% (4 mg) ir 14% (8 mg) insulino derinyje su AVANDIA. [Pamatyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS.]
Ilgalaikis AVANDIA, kaip monoterapijos, tyrimas
4–6 metų tyrimas (ADOPT) palygino AVANDIA (n = 1 456), gliburido (n = 1 441) ir metformino (n = 1 454) vartojimą kaip monoterapija pacientams, kuriems neseniai diagnozuotas 2 tipo cukrinis diabetas ir kurie anksčiau nebuvo gydomi diabetu vaistas. 5 lentelėje pateiktos nepageidaujamos reakcijos neatsižvelgiant į priežastinį ryšį; normos yra išreikštos 100 paciento metų (PY) ekspozicijos, atsižvelgiant į tiriamųjų vaistų ekspozicijos skirtumus 3 gydymo grupėse.
ADOPT metu lūžiai pasireiškė didesniam skaičiui AVANDIA gydytų moterų (9,3 proc., 2,7 / 100). paciento metų), palyginti su gliburidu (3,5%, 1,3 / 100 paciento metų) arba metforminu (5,1%, 1,5 / 100 paciento metai).
Dauguma roziglitazoną vartojusių moterų lūžių buvo žasto, plaštakos ir pėdos lūžiai. [Pamatyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS.] 3 pacientų grupėse pastebėtas kaulų lūžių dažnis buvo panašus.
5 lentelė. Terapinės terapijos nepageidaujami reiškiniai (5 įvykiai / 100 paciento metų [PY]) bet kurioje gydymo grupėje, apie kuriuos pranešta per 4–6 metų AVANDIA klinikinį tyrimą kaip monoterapiją (ADOPT).
| AVANDIJA N = 1,456 PY = 4,954 |
Glyburidas N = 1,441 PY = 4 244 |
Metforminas N = 1,454 PY = 4,906 |
|
| Nazofaringitas | 6.3 | 6.9 | 6.6 |
| Nugaros skausmas | 5.1 | 4.9 | 5.3 |
| Artralgija | 5.0 | 4.8 | 4.2 |
| Hipertenzija | 4.4 | 6.0 | 6.1 |
| Viršutinių kvėpavimo takų infekcija | 4.3 | 5.0 | 4.7 |
| Hipoglikemija | 2.9 | 13.0 | 3.4 |
| Viduriavimas | 2.5 | 3.2 | 6.8 |
Vaikų
Buvo įvertintas Avandia saugumas atliekant vieną aktyvų kontroliuojamą II tipo cukriniu diabetu sergančių vaikų tyrimą, kuriame 99 buvo gydyti Avandia, o 101 - metforminu. Nepaisant Avandia ar metformino priežastinio ryšio, dažniausiai pasitaikė nepageidaujamų reakcijų (> 10%) galvos skausmas (17% palyginti su 14%), pykinimas (4% prieš 11%), nosiaryklės uždegimas (3% prieš 12%) ir viduriavimas (1% palyginti su 13%). Šiame tyrime buvo pranešta apie vieną diabetinės ketoacidozės atvejį metformino grupėje. Be to, rosiglitazono grupėje buvo 3 pacientai, kurių FPG buvo ≥ 300 mg / dL, 2+ ketonurija ir padidėjęs anijonų tarpas.
Laboratoriniai anomalijos
Hematologinis
Gydytų suaugusių pacientų vidutinis hemoglobino ir hematokrito sumažėjimas priklausė nuo dozės vartojant Avandia (atskirų tyrimų metu hemoglobino koncentracija sumažėja vidutiniškai 1,0 g / dL ir net 3,3%) hematokritas). Pokyčiai daugiausia įvyko per pirmuosius 3 mėnesius nuo gydymo Avandia pradžios arba padidinus Avandia dozę. Sumažėjimo laikas ir mastas buvo panašūs pacientams, gydytiems Avandia ir kitų hipoglikeminių vaistų deriniu arba monoterapijai Avandia. Imuninio hemoglobino ir hematokrito lygis prieš gydymą buvo mažesnis metformino derinio tyrime dalyvavusiems pacientams ir tai galėjo prisidėti prie didesnio anemijos pranešimo dažnio. Vieno tyrimo su vaikais metu metu sumažėjo hemoglobino ir hematokrito rodikliai (vidutiniškai sumažėjo 0,29 g / dL ir 0,95%). Taip pat pastebėtas nedidelis hemoglobino ir hematokrito sumažėjimas vaikams, gydytiems Avandia. Baltųjų kraujo kūnelių skaičius taip pat šiek tiek sumažėjo suaugusiems pacientams, gydytiems Avandia. Hematologinių parametrų sumažėjimas gali būti susijęs su padidėjusiu kraujo plazmos tūriu, stebėtu gydant Avandia.
Lipidai
Po gydymo Avandia suaugusiesiems buvo stebimi lipidų koncentracijos serume pokyčiai [žr Klinikinė farmakologija ]. Buvo pranešta apie nedidelius serumo lipidų parametrų pokyčius vaikams, gydytiems Avandia 24 savaites.
Serumo transaminazių lygiai
Išankstinio patvirtinimo klinikiniuose tyrimuose, kuriuose dalyvavo 4 598 pacientai, gydyti Avandia (3600 paciento metų ekspozicija), o ilgalaikis - nuo 4 iki 6 metų trukmės tyrimas, kuriame dalyvavo 1 456 pacientai, gydyti Avandia (4 954 paciento metai), vaistų sukeltų požymių nenustatyta. hepatotoksiškumas.
Preliminarių kontroliuojamų tyrimų metu 0,2% pacientų, gydytų Avandia, ALAT aktyvumas buvo padidėjęs daugiau kaip 3 kartus viršijant viršutinę normos ribą, palyginti su 0,2% vartojusių placebą ir 0,5% aktyvių palyginamųjų. ALAT padidėjimas pacientams, gydytiems Avandia, buvo grįžtamas. Hiperbilirubinemija buvo nustatyta 0,3% pacientų, gydytų Avandia, palyginti su 0,9% pacientų, gydytų placebu, ir 1% pacientų, gydytų aktyviu lyginamuoju preparatu. Išankstinio patvirtinimo klinikiniuose tyrimuose nebuvo jokių idiosinkratiškų vaistų reakcijų, sukeliančių kepenų nepakankamumą. [Pamatyti Įspėjimai ir atsargumo priemonės]
4–6 metų ADOPT tyrime pacientai buvo gydomi Avandia (4 954 paciento metų ekspozicija), gliburidu (4 244 paciento metų ekspozicija) arba Metformino (4 906 paciento metų ekspozicija), kaip ir monoterapijos, ALAT padidėjimo greitis buvo toks pat kaip> 3X viršutinės normos ribos (0,3 / 100 paciento metų) poveikis).
Patirtis po pateikimo į rinką
Po klinikinių tyrimų praneštų nepageidaujamų reakcijų, toliau aprašyti reiškiniai buvo nustatyti naudojant vaistą po Avandia. Kadangi apie šiuos reiškinius pranešama savanoriškai iš nežinomo dydžio populiacijos, neįmanoma patikimai įvertinti jų dažnio ar visada nustatyti priežastinį ryšį su narkotikų poveikiu.
Pacientams, gydomiems tiazolidindionu, gali būti sunkių nepageidaujamų reiškinių, galinčių baigtis mirtimi arba be jos pranešta apie padidėjusį tūrį (pvz., stazinis širdies nepakankamumas, plaučių edema ir pleuros išsiliejimas) [pamatyti Įspėjimas dėžutėje ir Įspėjimai ir atsargumo priemonės].
Po vaistinio preparato pateikimo į rinką gauta pranešimų apie hepatito, kurio kepenų fermentų kiekis padidėjo 3 ar daugiau kartų, skaičių Avandia viršutinė viršutinė normos riba ir kepenų nepakankamumas su mirtimi ir be jos, nors priežastingumo nebuvo nustatyta.
Bėrimas, niežėjimas, dilgėlinė, angioneurozinė edema, anafilaksinė reakcija ir Stivenso-Džonsono sindromas buvo reti.
Taip pat gauta pranešimų apie atsiradusią ar pasunkėjusią diabetinę geltonosios dėmės edemą su sumažėjusiu regėjimo aštrumu [žr Įspėjimai ir atsargumo priemonės].
viršuje
Vaistų sąveika
CYP2C8 inhibitoriai ir induktoriai
CYP2C8 inhibitorius (pvz., Gemfibrozilis) gali padidinti rosiglitazono AUC, o CYP2C8 induktorius (pvz., Rifampinas) - sumažinti rosiglitazono AUC. Todėl, jei gydymo rosiglitazonu metu pradedamas arba sustabdomas CYP2C8 inhibitorius ar induktorius, atsižvelgiant į klinikinį atsaką, gali reikėti pakeisti diabeto gydymą. [Pamatyti KLINIKINĖ FARMAKOLOGIJA.]
viršuje
Naudojimas tam tikrose populiacijose
Nėštumas
C nėštumo kategorija
Visi nėštumai, nepaisant narkotikų poveikio, gali turėti apsigimimų, praradimų ar kitokių nepageidaujamų pasekmių. Ši fono rizika padidėja nėštumų metu, kuriuos komplikuoja hiperglikemija, ir gali sumažėti, kai gera metabolizmo kontrolė. Pacientams, sergantiems cukriniu diabetu ar turintiems nėštumo diabetą, būtina palaikyti gerą metabolizmo kontrolę prieš pastojimą ir per visą nėštumą. Tokiems pacientams būtina atidžiai stebėti gliukozės kiekį kraujyje. Daugelis ekspertų rekomenduoja nėštumo metu skirti monoterapiją insulinu, kad gliukozės kiekis kraujyje būtų kuo artimesnis normaliai.
Duomenys apie žmones: Buvo pranešta, kad rosiglitazonas prasiskverbia pro žmogaus placentą ir yra vaisiaus audinio aptinkamas. Klinikinė šių išvadų reikšmė nežinoma. Tinkamų ir gerai kontroliuojamų nėščių moterų tyrimų nėra. AVANDIA nėštumo metu vartoti negalima.
Tyrimai su gyvūnais: Ankstyvojo žiurkių nėštumo metu implantacijai ar embrionų gydymui rosiglitazonu įtakos nebuvo, tačiau Gydymas vidutinio vėlyvumo nėštumo metu buvo susijęs su vaisiaus mirtimi ir augimo sulėtėjimu tiek žiurkėms, tiek triušiams. Teratogeniškumas nepastebėtas, kai dozė buvo ne didesnė kaip 3 mg / kg žiurkėms ir 100 mg / kg - triušiams (atitinkamai atitinkamai maždaug 20 ir 75 kartų didesnė už žmogaus AUC, naudojant maksimalią rekomenduojamą žmogaus paros dozę). Rosiglitazonas sukėlė placentos patologiją žiurkėms (3 mg / kg per parą). Žiurkių gydymas nėštumo metu laktacijos metu sumažino vadų dydį, naujagimių gyvybingumą ir postnatalinį augimą, o augimo sulėtėjimas buvo grįžtamas po brendimo. Poveikis placentai, embrionui / vaisiui ir palikuonims buvo 0,2 mg / kg per parą žiurkėms ir 15 mg / kg per parą triušiams. Šios didžiausios rekomenduojamos paros dozės, kurios neturi jokio poveikio, AUC yra maždaug keturis kartus didesnės nei AUC. Rosiglitazonas sumažino gimdos implantacijų ir gyvų palikuonių skaičių, kai jauniklių žiurkių patelės buvo gydomos 40 mg / kg per parą nuo 27 dienų amžiaus iki lytinės brandos (maždaug 68 kartus didesnis už žmogaus AUC, esant maksimaliai rekomenduojamai paros dozei dozė). Nebuvo jokio poveikio lygio 2 mg / kg per parą (maždaug 4 kartus didesnis nei žmogaus AUC, vartojant didžiausią rekomenduojamą paros dozę). Poveikis nei prieš, nei po gimdymo ar augimui įtakos neturėjo.
Darbas ir pristatymas
Rosiglitazono poveikis gimdymui ir gimdymui nėra žinomas.
Slaugos motinos
Žindomų žiurkių piene buvo nustatyta su vaistais susijusi medžiaga. Nežinoma, ar AVANDIA patenka į motinos pieną. Kadangi daug vaistų išsiskiria į motinos pieną, AVANDIA neturėtų būti skiriama krūtimi maitinančiai moteriai.
Naudojimas vaikams
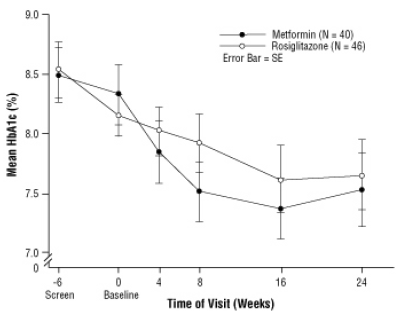
Po placebo vartojimo, įskaitant dietos patarimą, vaikams, sergantiems 2 tipo cukriniu diabetu, nuo 10 iki 17 metų, kurių pradinis vidutinis kūno masės indeksas (KMI) yra 33 24 kg dvigubai aklo klinikinio tyrimo metu atsitiktinės imties būdu buvo paskirta 2 mg AVANDIA dozė du kartus per parą (n = 99) arba 500 mg du kartus per parą metformino (n = 101). teismo procesas. Kaip ir tikėtasi, FPG sumažėjo pacientams, kurie dar nebuvo gydomi diabetu (n = 104), ir padidėjo pacientams, kuriems buvo nutrauktas ankstesnis gydymas (paprastai metforminas) (n = 90) pradinio gydymo laikotarpiu. Po mažiausiai 8 gydymo savaičių 49% AVANDIA gydytų pacientų ir 55% metforminu gydytų pacientų dozė padvigubėjo, jei FPG> 126 mg / dL. Vidutinis HBA1c pokytis, palyginti su pradiniu rodikliu, 24 savaitėje, palyginti su pradiniu rodikliu, buvo –0,14%, vartojant AVANDIA, ir –0,49%, palyginti su metforminu. Šiame tyrime nebuvo pakankamai pacientų, kad būtų galima statistiškai nustatyti, ar jie tokie
stebėtas vidutinis gydymo poveikis buvo panašus arba skirtingas. Gydymo poveikis pacientams, kurie anksčiau nebuvo gydyti antidiabetiniais vaistais, ir pacientams, kurie anksčiau buvo gydomi antidiabetiniais vaistais, skyrėsi (6 lentelė).
6 lentelė. 24 savaitė FPG ir HbA1c pokyčiai, palyginti su pradiniu paskutinio stebėjimo periodu, vaikams, kurių pradinis HbA1c lygis yra> 6,5%
| Niekada pacientai | Anksčiau gydyti pacientai | |||
|
Metforminas N = 40 |
Rosiglitazonas N = 45 |
Metforminas N = 43 |
Rosiglitazonas N = 32 |
|
| FPG (mg / dL) | ||||
| Pradinė vertė (vidurkis) | 170 | 165 | 221 | 205 |
| Pokytis nuo pradinio (vidutinis) | -21 | -11 | -33 | -5 |
| Koreguotas gydymo skirtumas * (rosiglitazonas-metforminas) â € (95% PI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % pacientų, kuriems sumažėjo 30 mg / dl, palyginti su pradiniu rodikliu | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Pradinė vertė (vidurkis) | 8.3 | 8.2 | 8.8 | 8.5 |
| Pokytis nuo pradinio (vidutinis) | -0.7 | -0.5 | -0.4 | 0.1 |
| Koreguotas gydymo skirtumas * (rosiglitazonas-metforminas) â € (95% PI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % pacientų, kuriems sumažėjo 0,7%, palyginti su pradiniu rodikliu | 63% | 52% | 54% | 31% |
|
* Pokytis, palyginti su pradiniu vidurkiu, yra mažiausias kvadratas, reiškiantis HbA1c, lyties ir regiono pradinę reikšmę. †Teigiamos skirtumo vertės palankiai veikia metforminą. |
Gydymo skirtumai priklausė nuo pradinio KMI ar svorio, todėl AVANDIA ir metformino poveikis labiau panašus į sunkesnius pacientus. Vidutinis svorio padidėjimas buvo 2,8 kg vartojant rosiglitazoną ir 0,2 kg vartojant metforminą [žr ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS]. Penkiasdešimt keturi procentai pacientų, gydytų roziglitazonu, ir 32% pacientų, gydytų metforminu, įgijo 2 kg, o 33% pacientų, gydytų roziglitazonu, ir 7% pacientų, gydytų metforminu, priaugo 5 kg tyrimas.
Šiame tyrime pastebėti nepageidaujami reiškiniai yra aprašyti skyriuje „Nepageidaujamos reakcijos“.
3 pav. Vidutinis HbA1c kiekis laikui bėgant 24 savaičių AVANDIA ir metformino tyrime vaikams - Narkotikų pogrupis
Geriatrinis vartojimas
Populiacijos farmakokinetinės analizės rezultatai parodė, kad amžius reikšmingos įtakos rosiglitazono farmakokinetikai nedaro [žr. KLINIKINĖ FARMAKOLOGIJA]. Todėl senyviems žmonėms dozės keisti nereikia. Kontroliuojamų klinikinių tyrimų metu vyresnių (overall ¥ effectiveness 65 metų) ir jaunesnių (<65 metų) pacientų saugumo ir veiksmingumo skirtumų nepastebėta.
viršuje
Perdozavimas
Duomenų apie perdozavimą žmonėms yra nedaug. Klinikinių tyrimų su savanoriais metu AVANDIA buvo skiriama vienkartinėmis geriamomis iki 20 mg dozėmis ir buvo gerai toleruojama. Perdozavus, reikia pradėti tinkamą palaikomąjį gydymą, atsižvelgiant į paciento klinikinę būklę.
viršuje
apibūdinimas
AVANDIA (rosiglitazono maleatas) yra geriamasis diabetas, veikiantis pirmiausia padidindamas jautrumą insulinui. AVANDIA pagerina glikemijos kontrolę ir sumažina cirkuliuojančio insulino kiekį kraujyje.
Rosiglitazono maleatas nėra chemiškai ar funkciškai susijęs su sulfonilkarbamidais, biguanidais ar alfa-gliukozidazės inhibitoriais.
Chemiškai rosiglitazono maleatas yra (±) -5 - [[4- [2- (metil-2-piridinilamino) etoksi] fenil] fenil] metil] -2,4-tiazolidindiono, (Z) -2-butenedioato (1: 1). kurio molekulinė masė 473,52 (laisvoji bazė 357,44). Molekulė turi vieną chiralinį centrą ir yra kaip racematas. Dėl greito tarpusavio virsmo enantiomerai funkciškai nesiskiria. Rosiglitazono maleato struktūrinė formulė yra:
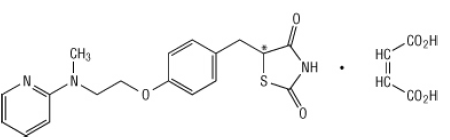
Molekulinė formulė yra C18H19N3O3S-C4H4O4. Rosiglitazono maleatas yra balta arba beveik balta kieta medžiaga, kurios lydymosi temperatūra yra nuo 122 iki 123 ° C. Rosiglitazono maleato pKa vertės yra 6,8 ir 6,1. Jis lengvai tirpsta etanolyje ir a buferinis vandeninis tirpalas, kurio pH yra 2,3; tirpumas mažėja didėjant pH fiziologiniam diapazonas.
Kiekvienoje penkiakampėje plėvele dengtoje TILTAB tabletėje yra 2 mg, 4 mg arba 8 mg rosiglitazono maleato, atitinkančio rosiglitazoną. Neaktyvieji komponentai yra: hipromeliozė 2910, laktozės monohidratas, magnio stearatas, mikrokristalinė celiuliozė, polietilenglikolis 3000, natrio krakmolo glikolatas, titano dioksidas, triacetinas ir 1 ar daugiau šių medžiagų: Sintetiniai raudonieji ir geltonieji geležies oksidai ir talkas.
viršuje
Klinikinė farmakologija
Veiksmo mechanizmas
Rosiglitazonas, priklausantis tiazolidinedionų grupės antidiabetiniams vaistams, pagerina glikemijos kontrolę, pagerindamas jautrumą insulinui. Rosiglitazonas yra labai selektyvus ir stiprus peroksisomų proliferatorių suaktyvinto gama receptoriaus (PPARγ) agonistas. Žmonėse PPAR receptoriai randami pagrindiniuose tiksliniuose audiniuose, kuriuose veikia insulinas, tokiuose kaip riebalinis audinys, griaučių raumenys ir kepenys. PPARγ branduolinių receptorių aktyvinimas reguliuoja į insuliną reaguojančių genų, dalyvaujančių kontroliuojant gliukozės gamybą, pernešimą ir panaudojimą, transkripciją. Be to, į PPARγ reaguojantys genai taip pat dalyvauja riebalų rūgščių metabolizmo reguliavime.
Atsparumas insulinui yra bendras bruožas, apibūdinantis 2 tipo diabeto patogenezę. Antidiabetinis rosiglitazono aktyvumas buvo įrodytas II tipo diabeto gyvūnų modeliuose kuri hiperglikemija ir (arba) sutrikusi gliukozės tolerancija yra tikslinio atsparumo insulinui pasekmė audinius. Rosiglitazonas mažina gliukozės koncentraciją kraujyje ir mažina hiperinsulinemiją ob / nutukusioms pelėms, diabetinėms / diabetinėms pelėms ir riebalų / riebalų riebioms Zucker žiurkėms.
Gyvūnų modeliuose nustatyta, kad antidiabetinis rosiglitazono aktyvumas yra padidėjęs jautrumas insulino veikimui kepenyse, raumenyse ir riebaliniuose audiniuose. Farmakologiniai tyrimai su gyvūnų modeliais rodo, kad rosiglitazonas slopina kepenų gliukoneogenezę. Insulino reguliuojamo gliukozės nešiklio GLUT-4 ekspresija padidėjo riebaliniame audinyje. Rosiglitazonas nesukėlė hipoglikemijos II tipo diabeto gyvūnų modeliuose ir (arba) sutrikusi gliukozės tolerancija.
Farmakodinamika
Klinikiniai AVANDIA tyrimai nebuvo pašalinti iš pacientų, kurių anomalijos pakito lipidams.
Visų 26 savaičių kontroliuojamų tyrimų metu rekomenduojamomis dozėmis AVANDIA monoterapija buvo susijusi su bendrojo cholesterolio, MTL ir DTL padidėjimu bei laisvųjų riebalų rūgščių sumažėjimu. Šie pokyčiai statistiškai reikšmingai skyrėsi nuo placebo ar glicurido kontrolinės grupės (7 lentelė).
MTL padidėjimas pirmiausia įvyko per pirmuosius 1–2 gydymo AVANDIA mėnesius, o MTL lygis per visus tyrimus išliko didesnis nei pradinis. Laikui bėgant, DTL ir toliau augo. Dėl to MTL / DTL santykis pasiekė aukščiausią lygį po 2 mėnesių gydymo, o vėliau laikui bėgant mažėjo. Dėl laikino lipidų pokyčių pobūdžio 52 savaičių kontroliuojamas gliburido tyrimas yra tinkamiausias ilgalaikiam poveikiui lipidams įvertinti. Pradiniame tyrime, 26 savaitę ir 52 savaitę, vidutinis MTL / DTL santykis buvo atitinkamai 3,1, 3,2 ir 3,0, vartojant AVANDIA 4 mg du kartus per parą. Atitinkamos gliburido vertės buvo 3,2, 3,1 ir 2,9. Statistiškai reikšmingi buvo AVANDIA ir gliburido pokyčių skirtumai nuo pradinio 52 savaitę.
MTL ir DTL pokyčių po gydymo AVANDIA kartu su kitais hipoglikeminiais vaistais pobūdis paprastai buvo panašus į tą, kuris pasireiškė vartojant AVANDIA monoterapijoje.
Trigliceridų pokyčiai gydymo AVANDIA metu buvo skirtingi ir paprastai statistiškai nesiskyrė nuo placebo ar gliburido kontrolinės grupės.
7 lentelė. Vidutinių lipidų pokyčių suvestinė per 26 savaičių placebu kontroliuojamus ir 52 savaičių glicurido kontroliuojamus monoterapijos tyrimus
| Placebo kontroliuojamų tyrimų 26 savaitė | Glyburido kontroliuojamas 26 ir 52 savaites | ||||||
| Placebas | AVANDIJA | Gliburido titravimas | AVANDIA 8 mg | ||||
| 4 mg per dieną * | 8 mg per dieną * | 26 darbo diena | 52 darbo diena | 26 darbo diena | 52 darbo diena | ||
| Laisvosios riebalų rūgštys | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Pradinė (vidutinė)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Pokytis nuo pradinio (vidutinis) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| MTL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Pradinė (vidutinė)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Pokytis nuo pradinio (vidutinis) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Pradinė (vidutinė)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Pokytis nuo pradinio (vidutinis) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Kartą per dieną ir du kartus per parą dozavimo grupės buvo sujungtos. |
Farmakokinetika
Didžiausia rosiglitazono koncentracija plazmoje (Cmax) ir plotas po kreive (AUC) didėja proporcingai dozei per terapinę dozę (8 lentelė). Pusinės eliminacijos laikas yra 3–4 valandos ir nepriklauso nuo dozės.
8 lentelė. Vidutiniai (SD) Rosiglitazono farmakokinetiniai parametrai po vienkartinių peroralinių dozių (N = 32)
| Parametras | 1 mg badavimas | 2 mg badavimas | 8 mg badavimas | 8 mg Fed |
| AUC0-inf [ng-val / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Pusė gyvenimo [val.] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / val.] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = klirensas žodžiu. |
Absorbcija
Absoliutus rosiglitazono biologinis prieinamumas yra 99%. Didžiausia koncentracija plazmoje pastebima praėjus maždaug 1 valandai po vaisto vartojimo. Vartojant rosiglitazoną su maistu, bendra ekspozicija (AUC) nepakito, tačiau Cmax sumažėjo maždaug 28% ir Tmax vėlėjo (1,75 valandos). Šie pokyčiai nėra kliniškai reikšmingi; todėl AVANDIA galima vartoti valgant ar nevalgius.
Paskirstymas
Remiantis populiacijos farmakokinetine analize, vidutinis (CV%) roziglitazono pasiskirstymo tūris (Vss / F) yra maždaug 17,6 (30%) litro. Maždaug 99,8% rosiglitazono prisijungia prie plazmos baltymų, visų pirma su albuminu.
Metabolizmas
Rosiglitazonas ekstensyviai metabolizuojamas, nepakitęs vaistas išsiskiria su šlapimu. Pagrindiniai metabolizmo keliai buvo N-demetilinimas ir hidroksilinimas, po to konjugacija su sulfatu ir gliukurono rūgštimi. Visi cirkuliuojantys metabolitai yra žymiai silpnesni nei pirminiai, todėl nesitikima, kad jie prisidės prie rosiglitazono jautrumą insulinui sukeliančio aktyvumo.
In vitro duomenys rodo, kad daugiausia rosiglitazoną metabolizuoja citochromo P450 (CYP) izofermentas 2C8, o CYP2C9 prisideda prie nedidelio jo patekimo būdo.
Išsiskyrimas
Išgėrus arba į veną sušvirkštus [14C] rosiglitazono maleato, maždaug 64% ir 23% dozės buvo pašalinta su šlapimu ir išmatomis. Su [14C] susijusios medžiagos pusinės eliminacijos laikas plazmoje svyravo nuo 103 iki 158 valandų.
Pacientų, sergančių 2 tipo diabetu, populiacijos farmakokinetika
3 didelių klinikinių tyrimų, kuriuose dalyvavo 642 vyrai ir 405 moterys, sergantys 2 tipo diabetu (35 metų amžiaus), farmakokinetinės analizės iki 80 metų) parodė, kad rosiglitazono farmakokinetikai neturi įtakos amžius, rasė, rūkymas ar alkoholis vartojimas. Nustatyta, kad padidėjęs kūno svoris padidėja tiek peroralinis klirensas (CL / F), tiek pasiskirstymo tūris, esant pastoviai koncentracijai (Vss / F). Šiose analizėse stebimo svorio diapazono metu (nuo 50 iki 150 kg) numatomų CL / F ir Vss / F verčių intervalas atitinkamai pakito <1,7 karto ir <2,3 karto.
Be to, buvo įrodyta, kad rosiglitazono CL / F įtaką turi tiek svoris, tiek lytis, nes moterys yra mažesnės (apie 15%).
Specialiosios populiacijos
Geriatrinis
Populiacijos farmakokinetinės analizės rezultatai (n = 716 <65 metai; n = 331 ¥ ¥ 65 metai) parodė, kad amžius reikšmingos įtakos rosiglitazono farmakokinetikai nedaro.
Lytis
Populiacijos farmakokinetikos analizės rezultatai parodė, kad vidutinis per burną išleistas rosiglitazono klirensas yra moterų (n = 405) buvo maždaug 6% mažesnės, palyginti su vyrais, kurių kūno svoris toks pats (n = 405) 642).
Kaip monoterapija ir kartu su metforminu AVANDIA pagerino glikemijos kontrolę tiek vyrams, tiek moterims. Metformino derinio tyrimuose buvo įrodytas veiksmingumas, nesant glikemijos atsako lyčių skirtumų.
Monoterapijos tyrimų metu didesnis terapinis atsakas pastebėtas moterims; tačiau nutukusiems pacientams lyčių skirtumai nebuvo tokie akivaizdūs. Pagal tam tikrą kūno masės indeksą (KMI) moterys turi didesnę riebalų masę nei vyrai. Kadangi molekulinis taikinys PPARγ yra ekspresuojamas riebaliniuose audiniuose, ši diferencinė savybė gali bent iš dalies lemti didesnį moterų atsaką į AVANDIA. Kadangi terapija turėtų būti individualizuota, dozės koreguoti nereikia, atsižvelgiant tik į lytį.
Kepenų funkcijos sutrikimas
Netiesioginis geriamojo rosiglitazono klirensas buvo žymiai mažesnis pacientams, sergantiems vidutinio sunkumo ar sunkia kepenų liga (B ir C klasė pagal Child-Pugh klasę), palyginti su sveikais asmenimis. Dėl to neprisijungęs Cmax ir AUC0-inf padidėjo atitinkamai 2 ir 3 kartus. Kepenų ligomis sergančių pacientų rosiglitazono pusinės eliminacijos laikas buvo maždaug 2 valandomis ilgesnis nei sveikų asmenų.
Gydymo AVANDIA negalima pradėti, jei pacientas turi klinikinių aktyvaus poveikio įrodymų kepenų liga ar padidėjęs transaminazių kiekis serume (ALAT> 2,5 karto viršija viršutinę normos ribą) prieš pradedant gydymą [pamatyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS].
Vaikų
Farmakokinetiniai rosiglitazono parametrai vaikams buvo nustatyti naudojant populiacijos farmakokinetinę analizę, turint mažai duomenų iš 96 vaikų klinikiniame tyrime, kuriame dalyvavo 33 vyrai ir 63 moterys nuo 10 iki 17 metų (svoris nuo 35 iki 35 metų). 178,3 kg). Populiacijos vidurkis rosiglitazono CL / F ir V / F buvo atitinkamai 3,15 L / val. Ir 13,5 L. Šie CL / F ir V / F įverčiai atitiko tipinius parametrų įverčius iš ankstesnės suaugusiųjų populiacijos analizės.
Inkstų funkcijos sutrikimas
Kliniškai reikšmingų rosiglitazono farmakokinetikos skirtumų pacientams, sergantiems lengvu, nėra sunkus inkstų funkcijos sutrikimas arba pacientams, kuriems taikoma hemodializė, palyginti su pacientais, kurių inkstai normalūs funkcija. Todėl tokiems pacientams, vartojantiems AVANDIA, dozės keisti nereikia. Kadangi metforminas draudžiamas pacientams, kurių inkstų funkcija sutrikusi, metformino vartoti kartu su AVANDIA draudžiama.
Lenktynės
Populiacijos farmakokinetinės analizės, įskaitant baltaodžių, juodosios ir kitos etninės kilmės asmenis, rezultatai rodo, kad rasė neturi įtakos rosiglitazono farmakokinetikai.
Narkotikų ir vaistų sąveika
Vaistai, slopinantys, sukeliantys arba metabolizuojami citochromo P450
In vitro vaisto metabolizmo tyrimai rodo, kad roziglitazonas kliniškai reikšmingose koncentracijose neslopina nė vieno iš pagrindinių P450 fermentų. In vitro duomenys rodo, kad rosiglitazoną daugiausia metabolizuoja CYP2C8, o mažesniu mastu - 2C9. Įrodyta, kad AVANDIA (4 mg du kartus per parą) neturi kliniškai reikšmingo poveikio nifedipinas ir geriamieji kontraceptikai (etinilestradiolis ir noretindronas), kurie daugiausia metabolizuojami autorius CYP3A4.
Gemfibrozilis
Kartu vartojamas gemfibrozilis (600 mg du kartus per parą), CYP2C8 inhibitorius, ir rosiglitazonas (4 mg vieną kartą per parą). per parą) 7 dienas padidino rosiglitazono AUC 127%, palyginti su roziglitazono (4 mg vieną kartą per parą) skyrimu. vienas. Atsižvelgiant į galimus su doze susijusius nepageidaujamus reiškinius, vartojant rosiglitazoną, įvedus gemfibrozilį gali reikėti sumažinti roziglitazono dozę [žr. Narkomanų sąveika].
Rifampinas
Pranešama, kad, vartojant Rifampin (600 mg vieną kartą per parą), CYP2C8 induktorių, 6 dienas sumažėjo rosiglitazono AUC 66%, palyginti su vien roziglitazono (8 mg) vartojimu [žr. Narkomanų sąveika].4
Glyburidas
AVANDIA (2 mg du kartus per parą) vartojant kartu su glicuridu (3,75–10 mg per parą) 7 dienas, nepakito vidutinė pusiausvyrinė gliukozės koncentracija plazmoje 24 valandas plazmoje pacientams, sergantiems cukriniu diabetu, stabilizavosi vartojant gliceridą terapija. Sveikiems suaugusiems kaukaziečiams kartojant AVANDIA (8 mg vieną kartą per parą) dozes 8 dienas, gliburido AUC ir Cmax sumažėjo maždaug 30%. Japonijos tiriamiesiems gliburido AUC ir Cmax šiek tiek padidėjo kartu vartojant AVANDIA.
Glimepiridas
Vienkartinės išgertos glimepirido dozės 14 sveikų suaugusių asmenų nedarė kliniškai reikšmingo poveikio AVANDIA pusiausvyrinės būklės farmakokinetikai. Nėra kliniškai reikšmingo glimepirido AUC ir C sumažėjimomaks sveikiems suaugusiems žmonėms 8 dienas buvo stebimos po pakartotinių AVANDIA dozių (8 mg vieną kartą per parą) 8 dienas.
Metforminas
Kartu sveikiems žmonėms skiriama AVANDIA (2 mg du kartus per parą) ir metformino (500 mg du kartus per parą) 4 dienas savanoriai neturėjo jokios įtakos metformino ar metformino farmakokinetikai pusiausvyrinėje būsenoje rosiglitazonas.
Akarbozė
Sveikiems savanoriams 7 dienas paskyrus akarbozę (100 mg tris kartus per parą) 7 dienas, kliniškai reikšmingo poveikio vienkartinės geriamosios AVANDIA dozės farmakokinetika neturėjo.
Digoksinas
Pakartotinis 14 dienų AVANDIA (8 mg kartą per parą) dozavimas sveikiems savanoriams nepakito digoksino (0,375 mg kartą per parą) farmakokinetikos pusiausvyros būsenoje.
Varfarinas
Pakartotinis AVANDIA dozavimas neturėjo kliniškai reikšmingo poveikio varfarino enantiomerų pusiausvyrinės būklės farmakokinetikai.
Etanolis
Vienkartinis vidutinio stiprumo alkoholio vartojimas nepadidino ūminės hipoglikemijos rizikos 2 tipo cukriniu diabetu sergantiems pacientams, gydytiems AVANDIA.
Ranitidinas
Pirminis gydymas ranitidinu (150 mg du kartus per parą 4 dienas) sveikiems savanoriams nepakeitė nei vienkartinių geriamųjų, nei intraveninių roziglitazono dozių farmakokinetikos.
Šie rezultatai rodo, kad geriamojo rosiglitazono absorbcija nepakinta, esant padidėjusiam virškinimo trakto pH.
viršuje
Neklinikinė toksikologija
Kancerogenezė, mutagenezė, vaisingumo pablogėjimas
Kancerogenezė:
Buvo atliktas 2 metų kancerogeniškumo tyrimas su Charles River CD-1 pelėmis 0,4, 1,5 ir 6 mg / kg per parą dozėmis. dieta (didžiausia dozė, lygi maždaug 12 kartų didesniam žmogaus AUC, maksimaliai rekomenduojama žmogui per parą dozė). „Sprague-Dawley“ žiurkėms dvejus metus buvo duodama per burną, vartojant 0,05, 0,3 ir 2 mg / kg per parą dozes (didžiausia dozės atitiktis iki maždaug 10 ir 20 kartų didesnio nei žmogaus AUC, esant didžiausiai rekomenduojamai žiurkių patino ir patelės dienos paros dozei, atitinkamai).
Rosiglitazonas pelėms nebuvo kancerogeninis. Vartojant 1,5 mg / kg kūno svorio paros dozę, padidėjo riebalinės hiperplazijos dažnis (maždaug 2 kartus didesnis už žmogaus AUC, vartojant maksimalią rekomenduojamą žmogaus paros dozę). Žiurkėms pastebimai padidėjo gerybinių riebalinio audinio navikų (lipomų) dažnis. 0,3 mg / kg per parą dozėmis (maždaug 2 kartus didesnis už žmogaus AUC, esant maksimaliai rekomenduojamai žmogaus paros dozei). Šie proliferaciniai abiejų rūšių pokyčiai yra svarstomi dėl nuolatinio farmakologinio riebalinio audinio perdėto stimuliavimo.
Mutagenezė:
In vitro atliktuose genų mutacijų tyrimuose roziglitazonas nebuvo mutageninis ar klastogeninis. chromosomų aberacijos bandymas su žmogaus limfocitais, in vivo pelės mikrobranduolio testas ir in vivo / in vitro žiurkės UDS testas. In vitro pelių limfomos tyrime, esant metaboliniam aktyvinimui, mutacija šiek tiek padidėjo (maždaug 2 kartus).
Vaisingumo pablogėjimas:
Sušvirkšta iki 40 mg / kg per parą, Rosiglitazonas neturėjo įtakos žiurkių patinų poravimuisi ar vaisingumui (maždaug 116 kartų didesnis už žmogaus AUC, esant maksimaliai rekomenduojamai žmogaus paros dozei). Rosiglitazonas pakeitė estroosinį cikliškumą (2 mg / kg per parą) ir sumažino žiurkių patelių vaisingumą (40 mg / kg per parą) kartu su mažesnėmis žiurkių patelėmis. progesterono ir estradiolio koncentracija plazmoje (maždaug 20 ir 200 kartų didesnė už žmogaus AUC, esant maksimaliai rekomenduojamai žmogaus paros dozei) atitinkamai). Vartojant 0,2 mg / kg per parą, toks poveikis nepastebėtas (maždaug 3 kartus didesnis už žmogaus AUC, esant maksimaliai rekomenduojamai žmogaus paros dozei). Jauniklių žiurkių, vartojusių nuo 27 dienų amžiaus iki lyties brandos (iki 40 mg / kg per parą), poveikis vyrų reprodukcijai nebuvo dėl žalingo cikliškumo, poravimosi ar nėštumo dažnio (maždaug 68 kartus didesnis už žmogaus AUC, esant maksimaliai rekomenduojamai žmogaus paros dienai) dozė). Beždžionėse roziglitazonas (0,6 ir 4,6 mg / kg per parą; maždaug 3 ir 15 kartų didesnis nei žmogaus AUC (atitinkamai atitinkamai didžiausia rekomenduojama paros dozė žmogui) sumažino folikulų fazės padidėjimą serumo estradiolyje, dėl to sumažėja liuteinizuojančio hormono antplūdis, sumažėja liutealinės fazės progesterono lygis ir amenorėja. Atrodo, kad šių reiškinių mechanizmas yra tiesioginis kiaušidžių steroidogenezės slopinimas.
Gyvūnų toksikologija
Širdies svoris padidėjo pelėms (3 mg / kg / dieną), žiurkėms (5 mg / kg / dieną) ir šunims (2 mg / kg / dieną), vartojant rosiglitazoną. gydymas (atitinkamai maždaug 5, 22 ir 2 kartus didesnis už žmogaus AUC, naudojant maksimalią rekomenduojamą žmogaus paros dozę). Poveikis žiurkėms jaunikliams buvo toks pats kaip ir suaugusiesiems. Morfometrinis matavimas parodė, kad širdies skilvelių audiniuose yra hipertrofija, kurią gali lemti padidėjęs širdies darbas dėl plazmos tūrio padidėjimo.
viršuje
Klinikiniai tyrimai
Monoterapija
Klinikinių tyrimų metu gydymas AVANDIA pagerino glikemijos kontrolę, matuojant FPG ir HbA1c, kartu sumažinant insulino ir C-peptido kiekį. Po valgio gliukozė ir insulinas taip pat buvo sumažinti. Tai atitinka AVANDIA, kaip jautrumo insulinui, veikimo mechanizmą.
Didžiausia rekomenduojama paros dozė yra 8 mg. Dozės keitimo tyrimai rodo, kad, vartojant 12 mg paros dozę, papildomos naudos negauta.
Trumpalaikiai klinikiniai tyrimai: Iš viso 2 235 pacientai, sergantys 2 tipo cukriniu diabetu, anksčiau gydyti vien dieta ar vaistais nuo diabeto, buvo gydyti AVANDIA kaip monoterapija 6 dvigubai akluose. tyrimai, kurie apėmė du 26 savaičių placebu kontroliuojamus tyrimus, vieną 52 savaičių gliburido kontroliuojamą tyrimą ir 3 placebo kontroliuojamus 8–12 savaičių dozės diapazono tyrimus. Ankstesni vaistai nuo diabeto buvo nutraukti, o pacientai prieš atsitiktinumą pateko į 2–4 savaičių placebo vartojimo periodą.
Du 26 savaičių, dvigubai akli, placebu kontroliuojami tyrimai pacientams, sergantiems 2 tipo cukriniu diabetu (n = 1401) ir esant nepakankamam glikemijos kiekiui. kontrolinė (vidutinė pradinė FPG maždaug 228 mg / dL [101–425 mg / dL] ir vidutinė pradinė HbA1c reikšmė 8,9% [5,2–16,2%]) buvo vedė. Gydymas AVANDIA parodė statistiškai reikšmingą FPG ir HbA1c pagerėjimą, palyginti su pradiniu rodikliu ir lyginant su placebu. Vieno iš šių tyrimų duomenys yra apibendrinti 9 lentelėje.
9 lentelė. Glikemijos parametrai 26 savaičių placebu kontroliuojamame tyrime
| Placebas N = 173 |
AVANDIJA | AVANDIJA | |||
| 4 mg vieną kartą per parą N = 180 |
2 mg du kartus per parą N = 186 |
8 mg vieną kartą per parą N = 181 |
4 mg du kartus per parą N = 187 |
||
| FPG (mg / dL) | |||||
| Pradinė vertė (vidurkis) | 225 | 229 | 225 | 228 | 228 |
| Pokytis nuo pradinio (vidutinis) | 8 | -25 | -35 | -42 | -55 |
| Skirtumas nuo placebo (pakoreguotas vidurkis) | - | -31* | -43* | -49* | -62* |
| % pacientų, kuriems sumažėjo 30 mg / dl, palyginti su pradiniu rodikliu | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Pradinė vertė (vidurkis) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Pokytis nuo pradinio (vidutinis) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Skirtumas nuo placebo (pakoreguotas vidurkis) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % pacientų, kuriems sumažėjo 0,7%, palyginti su pradiniu rodikliu | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001, palyginti su placebu. |
Vartojant tą pačią bendrą paros dozę, AVANDIA paprastai veiksmingiau mažino FPG ir HbA1c, kai buvo skiriama dalimis po du kartus per parą, palyginti su vienkartinėmis dozėmis. Tačiau skirtumas tarp HbA1c nebuvo tarp 4 mg kartą per parą ir 2 mg du kartus per parą statistiškai reikšmingo.
Ilgalaikiai klinikiniai tyrimai
Ilgalaikis efekto palaikymas buvo įvertintas 52 savaičių dvigubai aklu būdu kontroliuojamo gliburido tyrimu pacientams, sergantiems 2 tipo diabetu. 52 savaites pacientai buvo atsitiktinai suskirstyti į gydymą AVANDIA 2 mg du kartus per parą (N = 195) arba AVANDIA 4 mg du kartus per parą (N = 189) arba gliburidu (N = 202). Pacientams, vartojantiems gliburidą, buvo skiriama pradinė dozė: 2,5 mg per parą arba 5,0 mg per parą. Po to dozė buvo titruojama po 2,5 mg per parą per kitas 12 savaičių, siekiant maksimalios 15,0 mg per parą dozės, siekiant optimizuoti glikemijos kontrolę. Po to gliburido dozė buvo pastovi.
Vidutinė titruota gliburido dozė buvo 7,5 mg. Visi gydymo metodai statistiškai reikšmingai pagerino glikemijos kontrolę nuo pradinio lygio (4 ir 5 paveikslai). 52 savaitės pabaigoje FPG ir HbA1c sumažėjo nuo pradinio lygio -40,8 mg / dL ir -0,53% vartojant AVANDIA 4 mg du kartus per parą; -25,4 mg / dL ir -0,27% vartojant AVANDIA 2 mg du kartus per parą; ir -30,0 mg / dL ir -0,72% su glicuridu. HbA1c atveju skirtumas tarp AVANDIA 4 mg du kartus per parą ir gliburido nebuvo statistiškai reikšmingas 52 savaitę. Pradinis FPG sumažėjimas vartojant glicuridą buvo didesnis nei vartojant AVANDIA; tačiau laikui bėgant šis poveikis nebuvo toks patvarus.
Glikemijos kontrolės pagerėjimas, stebimas vartojant 4 mg AVANDIA du kartus per parą 26 savaitę, išliko 52 tyrimo savaitę.
4 pav. Vidutinis FPG laikui bėgant 52 savaičių glyburido kontroliuojamame tyrime
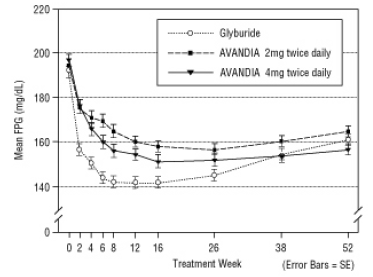
5 pav. Vidutinis HbA1c kiekis per 52 savaičių glicurido kontroliuojamą tyrimą

Hipoglikemija pasireiškė 12,1% gliburidu gydytų pacientų, palyginti su 0,5% (2 mg du kartus per parą) ir 1,6% (4 mg du kartus per parą) pacientų, gydytų AVANDIA. Glikemijos kontrolės pagerėjimas buvo susijęs su vidutiniu 1,75 kg ir 2,95 kg svorio padidėjimu pacientų, vartojusių atitinkamai 2 mg ir 4 mg AVANDIA per parą, palyginti su 1,9 kg gydytu glicuridu pacientai. AVANDIA gydytiems pacientams buvo suskaidyti C-peptidai, insulinas, proinsulinas ir proinsulinas žymiai sumažėja pagal dozę, palyginti su padidėjusiu apdoroto gliburido kiekiu pacientai.
Diabeto progresavimo tyrimas (ADOPT) buvo daugiacentris, dvigubai aklas, kontroliuojamas tyrimas (N = 4 351), kuris buvo atliekamas per 4–6 metus, siekiant palyginti saugumą ir veiksmingumą. pacientų, kuriems neseniai diagnozuotas 2 tipo cukrinis diabetas (3 ¤ 3 metai), kuriems nepakankamai kontroliuojama dieta ir pratimas. Vidutinis šio tyrimo pacientų amžius buvo 57 metai, o daugumai pacientų (83%) nebuvo žinomos širdies ir kraujagyslių ligos. Vidutinis pradinis FPG ir HbA1c buvo atitinkamai 152 mg / dL ir 7,4%. Pacientai buvo suskirstyti į atsitiktines grupes, vartojantiems AVANDIA 4 mg vieną kartą per parą, 2,5 mg gliburido kartą per parą arba 500 mg metformino kartą per parą. titruojama iki optimalios glikemijos kontrolės iki ne daugiau kaip 4 mg du kartus per parą AVANDIA, 7,5 mg du kartus per parą gliburidui ir 1000 mg du kartus per parą metformino. Pagrindinis veiksmingumo rezultatas buvo laikas, kai FPG buvo> 180 mg / dL, po mažiausiai 6 gydymo savaičių toleruota tiriamojo vaisto dozė arba laikas iki nepakankamos glikemijos kontrolės, kurią nustato nepriklausomas sprendimas komitetas.
Kumuliacinis pirminio veiksmingumo pasireiškimo dažnis po 5 metų buvo AVANDIA, 15%, vartojant metforminą, ir 34%. su gliburidu (pavojaus santykis 0,68 [95% PI 0,55, 0,85] palyginti su metforminu, HR 0,37 [95% PI 0,30, 0,45], palyginti su gliburidu).
Duomenys apie ADANDT vartojimą AVANDIA, metformino ir glicurido širdies ir kraujagyslių bei nepageidaujamų reiškinių (įskaitant poveikį kūno svoriui ir kaulų lūžiams) aprašyti ĮSPĖJIMAI IR ATSARGUMO PRIEMONĖS ir NEPALANKIOS REAKCIJOS, atitinkamai. Kaip ir visų kitų vaistų atveju, norint įvertinti galimą paciento naudos ir rizikos santykį, reikia atsižvelgti į veiksmingumo rezultatus kartu su informacija apie saugumą.
Derinys su metforminu arba sulfonilkarbamidu
Pridėjus AVANDIA prie metformino arba sulfonilkarbamido, labai sumažėjo hiperglikemija, palyginti su vienu iš šių vaistų atskirai. Šie rezultatai atitinka papildomą poveikį glikemijos kontrolei, kai AVANDIA vartojamas kaip kombinuotas gydymas.
Derinys su metforminu
Iš viso 670 pacientų, sergančių 2 tipo diabetu, dalyvavo dviejuose 26 savaičių, atsitiktinių imčių, dvigubai akluose, placebo / aktyviaisiais kontroliuojami tyrimai, skirti įvertinti AVANDIA veiksmingumą kartu su metformino. AVANDIA, skiriamas kas kartą per parą arba du kartus per parą, buvo skiriamas pacientų, kuriems nepakankamai kontroliuojama didžiausia metformino dozė (2,5 gramo per dieną), gydymui.
Vieno tyrimo metu pacientai nepakankamai kontroliavo metformino 2,5 g per parą dozę (vidutinė pradinė FPG 216 mg / dL ir vidutinė pradinė vertė). HbA1c 8,8%) atsitiktinės atrankos būdu gavo 4 mg AVANDIA vieną kartą per parą, 8 mg AVANDIA kartą per parą arba placebą, be metformino. Statistiškai reikšmingas FPG ir HbA1c pagerėjimas pastebėtas pacientams, gydomiems šių vaistų deriniais metformino ir 4 mg AVANDIA kartą per parą ir 8 mg AVANDIA kartą per parą, palyginti su pacientais, kurie toliau vartojo tik metforminą (10 lentelė).
10 lentelė. Glikemijos parametrai 26 savaičių AVANDIA Plus metformino derinio tyrime
| Metforminas N = 113 |
AVANDIJA 4 mg kartą per parą + metforminas N = 116 |
AVANDIJA 8 mg kartą per parą + metforminas N = 110 |
|
| FPG (mg / dL) | |||
| Pradinė vertė (vidurkis) | 214 | 215 | 220 |
| Pokytis nuo pradinio (vidutinis) | 6 | -33 | -48 |
| Skirtumas nuo vien metformino (pakoreguotas vidurkis) | - | -40* | -53* |
| % pacientų, kuriems sumažėjo 30 mg / dl, palyginti su pradiniu rodikliu | 20% | 45% | 61% |
| HbA1c (%) | |||
| Pradinė vertė (vidurkis) | 8.6 | 8.9 | 8.9 |
| Pokytis nuo pradinio (vidutinis) | 0.5 | -0.6 | -0.8 |
| Skirtumas nuo vien metformino (pakoreguotas vidurkis) | - | -1.0* | -1.2* |
| % pacientų, kuriems sumažėjo 0,7%, palyginti su pradiniu rodikliu | 11% | 45% | 52% |
| * p <0,0001, palyginti su metforminu. |
Antrame 26 savaičių tyrime pacientai, sergantys 2 tipo cukriniu diabetu, kurių metformino dozė buvo 2,5 g per parą, buvo atsitiktinai parinkti, vartojantys AVANDIA 4 mg du kartus per parą ir metforminas (N = 105) parodė statistiškai reikšmingą glikemijos kontrolės pagerėjimą, kai vidutinis FPG gydymo poveikis buvo –56 mg / dL, o vidutinis HbA1c gydymo poveikis –0,8%. vien metformino. Dėl metformino ir AVANDIA derinio FPG ir HbA1c koncentracija buvo mažesnė nei vartojant atskirai.
Pacientai, kuriems buvo nepakankamai kontroliuojama didžiausia metformino dozė (2,5 gramo per dieną) ir kurie buvo pereinant prie monoterapijos su AVANDIA, glikemijos kontrolė prarasta, o tai rodo padidėjęs FPG ir HbA1c. Šioje grupėje taip pat pastebėtas MTL ir LLDL padidėjimas.
Derinys su sulfonilkarbamidu
Iš viso dešimties 24–26 savaičių atsitiktinių imčių, dvigubai akluose, placebu / aktyviu būdu kontroliuojamuose tyrimuose dalyvavo 3457 2 tipo diabetu sergantys pacientai ir vienas. Dvejų metų dvigubai aklas, aktyvus, kontroliuojamas tyrimas su senyvo amžiaus pacientais, skirtas AVANDIA veiksmingumui ir saugumui įvertinti kartu su sulfonilkarbamidas. AVANDIA buvo skiriama 2 mg, 4 mg arba 8 mg per parą, vieną kartą per dieną (3 tyrimai) arba dalimis du kartus per parą (7 tyrimai) pacientams, kurių nepakankamai kontroliuojama sušvirkščiant maksimalią ar maksimalią dozę sulfonilkarbamidas.
Šių tyrimų metu AVANDIA 4 mg arba 8 mg paros dozė (skiriama po vieną arba du kartus per parą padalytomis dozėmis) ir a sulfonilkarbamidas žymiai sumažino FPG ir HbA1c, palyginti su placebu ir sulfonilkarbamidu, arba toliau didinant sulfonilkarbamidas. 11 lentelėje pateikti 8 tyrimų, kurių metu AVANDIA pridėta prie sulfonilkarbamido, duomenys buvo lyginami su placebu ir sulfonilkarbamidu.
11 lentelė. Glikemijos parametrai atliekant 24–26 savaičių AVANDIA Plus sulfonilkarbamido darinio tyrimus
| Du kartus per parą dalijamas dozavimas (5 tyrimai) | Sulfonilkarbamidas N = 397 |
AVANDIJA 2 mg du kartus per parą + sulfonilkarbamidas N = 497 |
Sulfonilkarbamidas N = 248 |
AVANDIJA 4 mg du kartus per parą + sulfonilkarbamidas N = 346 |
| FPG (mg / dL) | ||||
| Pradinė vertė (vidurkis) | 204 | 198 | 188 | 187 |
| Pokytis nuo pradinio (vidutinis) | 11 | -29 | 8 | -43 |
| Skirtumas nuo vien sulfonilkarbamido (pakoreguotas vidurkis) | - | -42* | - | -53* |
| % pacientų, kuriems sumažėjo 30 mg / dl, palyginti su pradiniu rodikliu | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Pradinė vertė (vidurkis) | 9.4 | 9.5 | 9.3 | 9.6 |
| Pokytis nuo pradinio (vidutinis) | 0.2 | -1.0 | 0.0 | -1.6 |
| Skirtumas nuo vien sulfonilkarbamido (pakoreguotas vidurkis) | - | -1.1* | - | -1.4* |
| % pacientų, kuriems sumažėjo 0,7%, palyginti su pradiniu rodikliu | 21% | 60% | 23% | 75% |
| Dozavimas vieną kartą per dieną (3 tyrimai) | Sulfonilkarbamidas N = 172 |
AVANDIJA 4 mg kartą per parą + sulfonilkarbamidas N = 172 |
Sulfonilkarbamidas N = 173 |
AVANDIJA 8 mg kartą per parą + sulfonilkarbamidas N = 176 |
| FPG (mg / dL) | ||||
| Pradinė vertė (vidurkis) | 198 | 206 | 188 | 192 |
| Pokytis nuo pradinio (vidutinis) | 17 | -25 | 17 | -43 |
| Skirtumas nuo vien sulfonilkarbamido (pakoreguotas vidurkis) | - | -47* | - | -66* |
| % pacientų, kuriems sumažėjo 30 mg / dl, palyginti su pradiniu rodikliu | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Pradinė vertė (vidurkis) | 8.6 | 8.8 | 8.9 | 8.9 |
| Pokytis nuo pradinio (vidutinis) | 0.4 | -0.5 | 0.1 | -1.2 |
| Skirtumas nuo vien sulfonilkarbamido (pakoreguotas vidurkis) | - | -0.9* | - | -1.4* |
| % pacientų, kuriems sumažėjo 0,7%, palyginti su pradiniu rodikliu | 11% | 36% | 20% | 68% |
| * p <0,0001, palyginti su vien sulfonilurėjos dariniu. |
Į vieną iš 24–26 savaičių tyrimų buvo įtraukti pacientai, kuriems buvo nepakankamai kontroliuojamos maksimalios gliburido dozės ir jie vartojo 4 mg AVANDIA kasdien kaip monoterapiją; šioje grupėje buvo įrodytas glikemijos kontrolės praradimas, ką patvirtina FPG ir HbA1c padidėjimas.
Dvejų metų dvigubai aklo tyrimo metu pagyvenę pacientai (nuo 59 iki 89 metų), vartojantys maksimalų sulfonilkarbamido darinį (10 mg glipizido du kartus per parą), buvo atsitiktinės atrankos būdu pridedant AVANDIA (n = 115, 4 mg vieną kartą per parą iki 8 mg, jei reikia) arba tęsiant gliutizido titravimą (n = 110), ne daugiau kaip po 20 mg du kartus kasdien. Vidutinis pradinis FPG ir HbA1c buvo atitinkamai 157 mg / dL ir 7,72% AVANDIA plius glipizido grupėje ir 159 mg / dL bei 7,65% atitinkamai padidėjus glipizido titravimo grupėje. Glikemijos kontrolės praradimas (FPG â ‰ ¥ mg 180 mg / dL) sumažėjo žymiai mažesnei daliai pacientų (2%), vartojusiems AVANDIA ir glipizidą, palyginti su pacientais, vartojusiais padidėjusį titruojamąjį vaistą glipizidu (28,7%). Apie 78% pacientų, gydytų kombinuotai, baigė dvejus gydymo metus, o tik 51% baigė gydymą glipizidu. Kombinuoto gydymo poveikis FPG ir HbA1c buvo ilgalaikis 2 metus trukusio tyrimo metu su pacientais vidutinis 132 mg / dL FPG ir 6,98% HbA1c vidurkis, palyginti su glipizidu ranka.
Derinys su sulfonilurėjos dariniu plius metforminu
Dviejų nuo 24 iki 26 savaičių trukmės dvigubai aklo, placebu kontroliuojamo tyrimo, skirto AVANDIA, vartojamo kartu su sulfonilkarbamido dariniu kartu su metforminu, AVANDIA 4 mg ar 8 mg, veiksmingumui ir saugumui įvertinti, metu. per parą, buvo skiriama dalimis po du kartus per parą, pacientams, kurių nepakankamai kontroliuojamos skiriant submaksimalią (10 mg) ir maksimalią (20 mg) gliburido dozes bei didžiausią metformino dozę (2). g per dieną). Statistiškai reikšmingas FPG ir HbA1c pagerėjimas buvo stebimas pacientams, gydytiems sulfonilkarbamido deriniais kartu su metforminu ir 4 mg AVANDIA bei 8 mg AVANDIA, palyginti su pacientais, toliau vartojo sulfonilkarbamidą ir metforminą, kaip parodyta lentelėje. 12.
12 lentelė. Glikemijos parametrai 26 savaičių AVANDIA Plus sulfonilkarbamido ir metformino derinio tyrime
| Sulfonilkarbamidas + metformino N = 273 |
AVANDIJA 2 mg du kartus per parą + sulfonilkarbamidas + metforminas N = 276 |
AVANDIJA 4 mg du kartus per parą + sulfonilkarbamidas + metforminas N = 277 |
|
| FPG (mg / dL) | |||
| Pradinė vertė (vidurkis) | 189 | 190 | 192 |
| Pokytis nuo pradinio (vidutinis) | 14 | -19 | -40 |
| Skirtumas nuo sulfonilkarbamido ir metformino (pakoreguotas vidurkis) | - | -30* | -52* |
| % pacientų, kuriems sumažėjo 30 mg / dl, palyginti su pradiniu rodikliu | 16% | 46% | 62% |
| HbA1c (%) | |||
| Pradinė vertė (vidurkis) | 8.7 | 8.6 | 8.7 |
| Pokytis nuo pradinio (vidutinis) | 0.2 | -0.4 | -0.9 |
| Skirtumas nuo sulfonilkarbamido ir metformino (pakoreguotas vidurkis) | - | -0.6* | -1.1* |
| % pacientų, kuriems sumažėjo 0,7%, palyginti su pradiniu rodikliu | 16% | 39% | 63% |
| * p <0,0001, palyginti su placebu. |
viršuje
Nuorodos
- Maisto ir vaistų administracijos informacinis dokumentas. Bendras metabolizuojančių endokrininių vaistų ir vaistų saugos ir rizikos valdymo patariamųjų komitetų posėdis. 2007 m. Liepa.
- Svajonių tyrimo tyrėjai. Rosiglitazono poveikis diabeto dažniui, kai yra sutrikusi gliukozės tolerancija arba nevalgius gliukozės: atsitiktine tvarka kontroliuojama Lancetas 2006;368:1096-1105.
- Namų PD, Pocock SJ, Beck-Nielsen H ir kt. Rosiglitazonas įvertintas dėl širdies ir kraujagyslių sistemos baigčių - tarpinė analizė. NEJM 2007; 357: 1–11.
- „Park JY“, Kim KA, Kang MH ir kt. Rifampino poveikis sveikų asmenų rosiglitazono farmakokinetikai. Clin Pharmacol Ther 2004; 75: 157-162.
viršuje
Kaip tiekiama / saugojimas ir tvarkymas
Kiekvienoje penkiakampėje plėvele dengtoje TILTAB tabletėje yra rosiglitazono kaip maleato pavidalo: 2 mg rožinės spalvos, su įspaudu SB vienoje pusėje ir 2 kitoje; 4 mg oranžinės spalvos, su įspaudu SB iš vienos pusės ir 4 iš kitos; 8 mg raudonai rudos spalvos, vienoje pusėje įspausta SB, o kitoje - 8.
- 2 mg buteliukai po 60: NDC 0029-3158-18
- 4 mg buteliukai po 30: NDC 0029-3159-13
- 4 mg buteliukai po 90: NDC 0029-3159-00
- 8 mg buteliukai po 30: NDC 0029-3160-13
- 8 mg buteliukai po 90: NDC 0029-3160-59
Laikyti 25 ° C (77 ° F) temperatūroje; ekskursijos nuo 15 iki 30 C (59 - 86 F). Išpilkite į sandarų, šviesai atsparų indą.
paskutinį kartą atnaujintas 2008 02 02
Avandia, rosiglitazono maleatas, informacija apie pacientą (paprasta angliškai)
Išsami informacija apie diabeto požymius, simptomus, priežastis, gydymą
Šioje monografijoje pateikta informacija nėra skirta visoms galimoms naudojimo rūšims, nurodymams, atsargumo priemonėms, vaistų sąveikai ar neigiamam poveikiui. Ši informacija yra apibendrinta ir nėra skirta kaip specialūs medicinos patarimai. Jei turite klausimų apie vartojamus vaistus ar norite gauti daugiau informacijos, pasitarkite su gydytoju, vaistininku ar slaugytoja.
Atgal į:Naršykite visus vaistus nuo diabeto


